対照的なナトリウムおよび塩化物イオン
これは、ナトリウムイオンと塩化物イオンの違いの違いの内訳です。
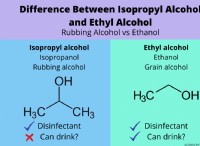
ナトリウムイオン(Na+)
* 層: ナトリウム(Na)は、最も外側のシェルに1つの電子を備えた金属です。安定したオクテット構成を実現するためにこの電子を容易に失い、正の帯電イオン(陽イオン)になります。このプロセスはイオン化と呼ばれます。
* シンボル: Na+
* プロパティ:
*小さなサイズ
*高電荷密度
*非常に反応性があり、容易にイオン結合を形成します
塩化物イオン(Cl-)
* 層: 塩素(Cl)は、最も外側の殻に7つの電子を備えた非金属です。安定したオクテット構成を実現するために1つの電子を獲得し、負に帯電したイオン(アニオン)になります。
* シンボル: cl-
* プロパティ:
*ナトリウムイオンよりも大きいサイズ
*電荷密度が低い
*ナトリウムイオンと比較して反応性が低い
重要な違い:
* チャージ: ナトリウムイオンは正に帯電します(Na+)が、塩化物イオンは負に帯電します(Cl-)。
* 層: ナトリウムは電子を失い、陽イオンを形成しますが、塩素は電子を獲得して陰イオンを形成します。
* サイズ: ナトリウムイオンは塩化物イオンよりも小さくなっています。
* 反応性: ナトリウムイオンは塩化物イオンよりも反応性があります。
それらがどのように形成されるか:
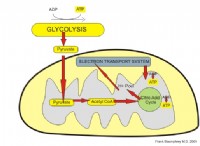
ナトリウムと塩素原子はイオン結合を形成します。この結合は、反対に帯電したイオン間の静電引力のために形成されます。ナトリウム原子(NA)が塩素原子(CL)と相互作用すると、ナトリウム原子はその最も外側の電子を塩素原子に失います。ナトリウム原子は正に帯電したナトリウムイオン(Na+)になり、塩素原子は負に帯電した塩化物イオン(Cl-)になります。これらの反対に帯電したイオンは互いに引き付けられ、イオン化合物塩化ナトリウム(NaCl)またはテーブル塩を形成します。
要約:
ナトリウムイオンと塩化物イオンは、多くの生物学的プロセスに不可欠な成分であり、異なる形成プロセスと電荷により異なる特性を持っています。それらの相互作用は、塩化ナトリウムのようなイオン化合物の形成につながります。これは、私たちの生活の中で重要な役割を果たしています。