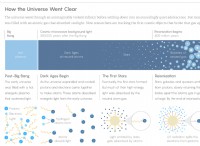
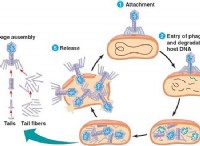
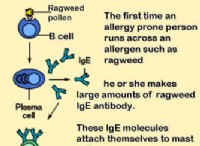
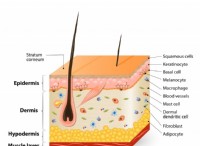
水性アンモニアの溶解度を理解
水性アンモニア(NH 3 (AQ))は基本的なソリューションです。溶解度はいくつかの要因の影響を受けていることを覚えておくことが重要です。
* 溶質の性質: 化合物の化学的性質は、特定の溶媒に溶解する能力を決定します。
* 極性: のようにのように。極性化合物は極性溶媒に溶解する傾向がありますが、非極性化合物は非極性溶媒に溶解します。
* 複合体の形成: 一部の化合物はアンモニアと反応して可溶性複合体を形成し、溶解度を高めます。
水性アンモニアの不溶性化合物の例:
* ほとんどの金属水酸化物: Fe(OH) 3 のような多くの金属水酸化物 (鉄(III)水酸化物)およびCu(OH) 2 (銅(II)水酸化物)は、水性アンモニアに不溶性です。これは、一般的に非常に極性がなく、アンモニアと強い複合体を形成しないためです。
* いくつかの金属硫化物: CUS(銅(II)硫化物)やHGS(水銀(II)硫化物)などの特定の金属硫化物も、水性アンモニアに不溶性です。
重要な考慮事項:
* 複雑な形成: 銀、銅、亜鉛、ニッケルなどの一部の金属は、アンモニアと可溶性複合体イオンを形成できます。たとえば、AgCl(塩化銀)は水に不溶ですが、可溶性複合体イオンの形成のために水性アンモニアに溶解します[ag(nh 3 ) 2 ] + 。
* pH効果: 溶液のpHは溶解度に影響を与える可能性があります。 高濃度のアンモニア溶液では、いくつかの化合物は、アンモニア分子の濃度が高いため、より大きな溶解度を示す可能性があります。
あなたの質問に明確に答えるには、興味のある特定の化合物を提供する必要があります。
化合物を教えてください、そして、それが水性アンモニアに不溶性である可能性があるかどうかを伝えることができます!