1。イオン結合:
* それがどのように起こるか: イオン結合は、1つの原子(より感動性のあるもの)が別の原子(電気陰性症のものが少ない)から完全に「盗む」と形成されます。これにより、2つの反対に帯電したイオンが作成されます。積極的に帯電した陽イオンと負に帯電した陰イオンです。 これらの反対の電荷間の静電引力は、イオンを一緒に保持します。
* 例: ナトリウム(Na)は電気陰性度が低く、電子を容易に失い、正に帯電したナトリウムイオン(Na+)になります。塩素(Cl)は高い電気陰性度を持ち、その電子を獲得して負に帯電した塩化物イオン(Cl-)になります。 Na+とCl-の間の強い引力は、テーブル塩としてよく知られているイオン化合物ナトリウム(NaCl)を形成します。
2。共有結合:
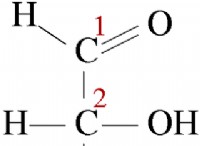
* それがどのように起こるか: 2つの原子が電子を共有すると、共有結合が形成されます。この共有は、等しい(非極性共有結合)または不均等(極性共有結合)になります。 非極性共有結合では、電子が均等に共有されます。極性共有結合では、電子は電気陰性度が高い原子に近づけられ、分子のわずかに陽性でわずかに負の端が生じます。
* 例: 水分子(H2O)では、酸素原子(O)は水素原子よりも電気陰性です(H)。酸素原子は共有電子をそれ自体に近づけ、酸素にわずかに負の電荷を生み出し、水素原子にわずかに正電荷を生成します。これは極性の共有結合です。
3。金属結合:
* それがどのように起こるか: 金属結合は金属で発生します。これは、原子価電子(最も外側のシェルの電子)が非局在化する特別なタイプの結合です。これは、金属構造全体を通して自由に移動できることを意味します。正に帯電した金属イオンは、非局在化された電子の海によって一緒に保持されます。
* 例: 銅の一部では、銅原子がその原子価電子を共有された「電子海」に寄与させます。これにより、電子が自由に動くことができ、銅はその高い電気伝導率と柔軟性(形を整える能力)を与えます。
キーポイント: 原子間で形成される結合のタイプは、主に関与する原子間の電気陰性度の違いに依存します。