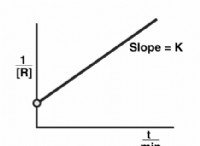
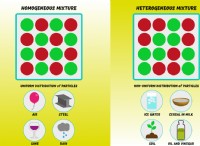
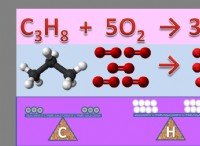
1。エネルギー:
* 活性化エネルギー: 分子は、活性化エネルギーとして知られる最小量の運動エネルギーを持ち、エネルギー障壁を克服し、新しい結合が形成されるために既存の結合を破壊する必要があります。
* 温度: 高温が高いほど、分子の平均運動エネルギーが増加し、衝突が反応に十分なエネルギーを持つ可能性が高くなります。
2。オリエンテーション:
* 衝突ジオメトリ: 分子は、反応性部位が相互作用するために特定の向きで衝突する必要があります。これはしばしば「ロックとキー」メカニズムとして描かれています。
* 立体障害: かさばる分子は、反応に必要な正しい方向を妨げる可能性があります。
3。化学的特性:
* 結合強度: 強い結合は、より多くのエネルギーを壊す必要があり、反応が発生する可能性が低くなります。
* 電気陰性度: 原子間の電気陰性度の違いは、形成された結合の種類と反応の可能性に影響します。
* 機能グループ: 特定の官能基(ヒドロキシル、カルボニル、またはアミノ基など)の存在は、分子の反応性を決定できます。
4。濃度:
* 衝突周波数: 反応物の濃度が高いほど衝突の頻度が増加し、反応が成功する可能性が高くなります。
5。触媒:
* 触媒: 反応の活性化エネルギーを低下させる物質は、消費されずに反応速度を増加させます。彼らは、より低いエネルギー障壁を備えた代替反応経路を提供することができます。
6。その他の要因:
* 溶媒効果: 溶媒周囲の反応物は、中間体の安定性または反応物の方向に影響を与えることにより、反応速度に影響を与える可能性があります。
* 圧力: 圧力の増加は、衝突の頻度を増やすことにより、ガスが関与する反応速度に影響を与える可能性があります。
要約:
化学反応につながる2つの分子間の衝突は、以下を含む因子の組み合わせに依存します。
* 活性化エネルギーを克服するのに十分な運動エネルギー。
* 反応性部位が相互作用する正しい方向。
* 好ましい化学的特性と結合強度。
* 反応物の適切な濃度。
* 潜在的な触媒。
これらの要因を理解することは、化学反応の結果を予測して制御するために重要です。