二次反応は、2 つの一次反応物質または1 つの二次反応物。
二次反応は上記の 2 つのタイプのいずれかである可能性があるため、それらの速度は次のように一般化できます。フォロー
r=k[A]x[B]y
反応率:
リアクションを aA + bB cC + dD とします
反応物濃度に関して、二次反応速度は r=k[A ]x[B]y
[A] および [B] この場合、反応物濃度は定数です。
x と y は実験的に決定された反応次数であり、化学量論係数 a と b ではありません。
化学反応の順序は、変数 x と y の合計によって決まります。二次反応は、x + y =2 の反応です。これは、一方の反応物質がその濃度の 2 乗に比例する速度 (速度 =k[A]2) で消費される場合、または両方の反応物質が一定の速度で消費される場合に発生する可能性があります。濃度の二乗に比例します (レート =k[A][B])。二次プロセスの速度定数 k は、M-1s-1 で測定されます。
いくつかの例:
N2O は一酸化窒素と酸素に分解されます。以下は応答です:
2N2O 2NO + O2
水素イオンとヒドロキシル イオンが水を構成します。
H+ +OH– H2O
塩基の存在下で、エステルの加水分解が起こります。
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
ヨウ化水素は、水素とヨウ素の 2 つのガスに分解されます。
2HI → H2+ I2
二次反応の微分および積分速度式
化学反応で特定の生成物を生成する二次反応物の例では、微分速度の法則式は次のとおりです:
-d[A]/dt =k[A]2
積分レート方程式を導出するには、この微分形式を次のように再配置する必要があります。
-d[A]/[A]2=-kdt
これらの反応の半減期:
化学反応の半減期は、反応物質の初期量の半分が移動するのにかかる時間です反応を通して。その結果、反応の半減期を決定しようとしている間、次の置換を行う必要があります:
R =[R]O2
および
t =t12
これらの値を二次反応の速度方程式の積分形式に代入すると、次のようになります。
1[R]02–1[R]0=kt1/2
結果として、二次反応の半減期式は次のように表すことができます。 /P>
t1/2=1k[R]0
一次反応と二次反応の違い :
二次反応のグラフ:
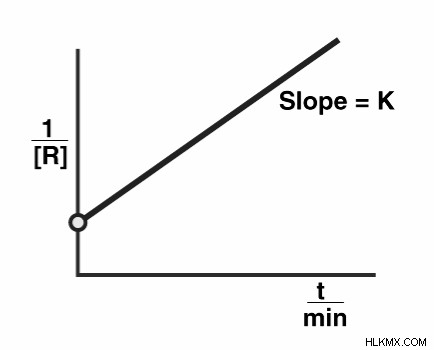
結論:
二次反応は、化学反応の一種で、結果が1 つの二次反応物または 2 つの一次反応物。二次反応では、速度法則の指数の合計は 2 になります。
r =k[A]x[B]y は二次反応の速度です。







