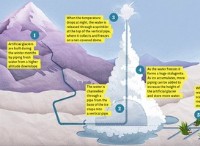
水に対する同様の分子(H₂O):
* 硫化水素(H₂S):
* 類似点:
*両方とも bent です または angular 形があります。
*両方とも、2つの水素原子に結合された中心原子(H₂Oの酸素、硫黄)を持っています。
*両方に極性共有結合があります 中心原子と水素間の電気陰性度の違いにより。
*両方とも水素結合を形成できます 他の分子では、硫化水素の結合は水よりも弱いです。
* 違い:
*硫黄は酸素よりも電気陰性が少ないため、H-S結合は極性が低くなります。
*硫化水素は、水素結合が弱いため、水よりもはるかに低い沸点を持っています。
*水は室温の液体であり、硫化水素はガスです。
* アンモニア(nh₃):
* 類似点:
*両方とも、水素原子に結合した中心原子(h₂oの酸素、nh₃の窒素)を持っています。
*両方とも極分子です 非対称の形状と極結合のため。
*両方とも水素結合を形成できます 他の分子と。
* 違い:
*アンモニアには三角錐体があります 水の曲がった形と比較した形状(ピラミッド様)。
*アンモニアは、水よりも弱い水素結合ドナーです。
* フッ化水素(HF):
* 類似点:
*両方に線形があります 形。
*両方に極性共有結合があります 中心原子(H₂Oの酸素、HFのフッ素)と水素の間。
*両方とも水素結合を形成できます 他の分子と。
* 違い:
* HFは、非常に強い水素結合により非常に高い沸点を持っています。
* HFは室温のガスです。
これらの分子を類似したものは何ですか?
これらの分子は次のとおりです。
* 極性共有結合: それらはすべて、電子が不均一に共有される結合を含み、中心原子にわずかな負電荷と水素原子にわずかな正電荷を作成します。
* 水素結合: 高強性原子(酸素、窒素、フッ素)に結合した水素原子の存在により、これらの分子は水素結合を形成することができます。これらの結合は、物理的および化学的特性にとって非常に重要です。
キーポイント:
これらの分子は類似性を共有しますが、電気陰性度、結合強度、および分子形状の違いは異なる特性につながります。