半減期の短い元素が存在するのは、各元素に安定同位体があり、同位体の崩壊によってさらに多くの同位体が生成されるためです。
特定の元素は半減期が非常に短いため、非常に速いペースで崩壊します。元素の半減期がこれほど短いのに、なぜ元素が存在するのか疑問に思うのは自然なことです。
この背後にある科学を理解するには、まず同位体、半減期、放射性崩壊などの特定の基本概念を理解することが不可欠です。ちなみに、同じ元素の原子が異なる数の中性子を持っている場合、それらは同位体として知られています。
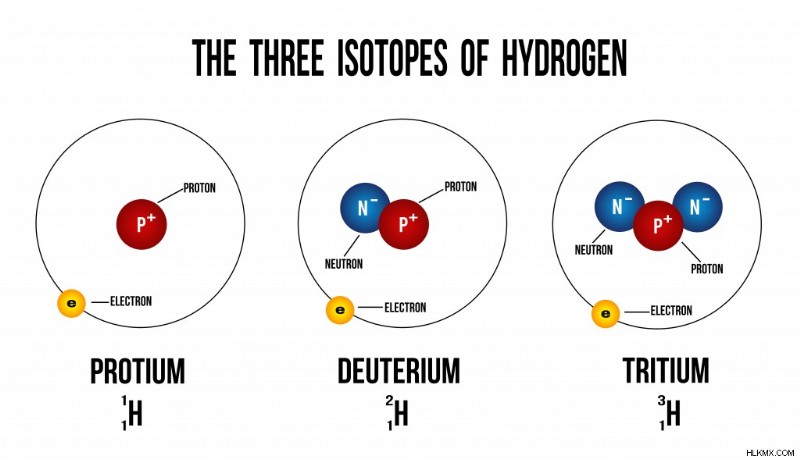
水素の同位体 (写真提供者:ducu59us/Shutterstock)
上の画像は、追加の中性子が水素のさまざまな同位体をどのように作成するかを示しています。同位体は同じ数の電子を持っているため、同じ化学的性質を持っています。ただし、質量 (中性子の数) の違いにより、要素の物理的特性には違いがあります。
半減期とは?
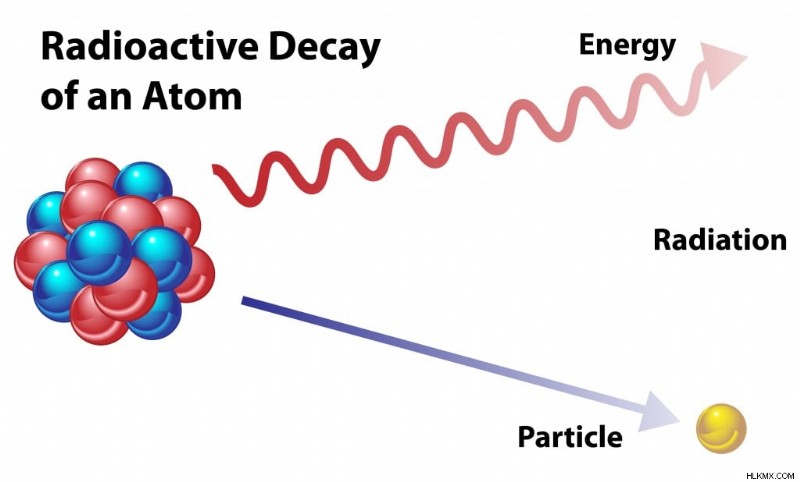
放射性崩壊 (写真提供:OSweetNature/Shutterstock)
原子が放射性崩壊を受けると、粒子が失われます。失われた粒子は、元の元素の量を減らすため、元の原子を別の同位体または元素に変えます。
「半減期とは、ある時点でサンプル中に存在する放射性核種の数がその値の半分になるまでにかかる時間です。」 (スティーブ・オーウェン、2014)
簡単に言えば、元素がその質量の半分を失うのに必要な時間が元素の半減期です。
たとえば、リンの同位体 (32P) の半減期は 14 日間です。この同位体が 20 グラムあったとしたら、14 日後には元の質量の半分が崩壊して 10 グラムしか残っていないことになります。さらに 14 日後には 5 グラム残っていました。次の図は、このリン同位体に対する半減期の影響を示しています。
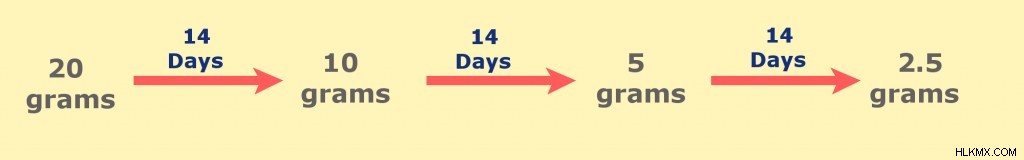
リン32の半減期
半減期の軌跡
すべての半減期は、崩壊に関して同様の軌跡をたどります。説明したように、各半減期の後、要素の質量は半分になります。これの結果のグラフは、減少する (絶対) 勾配で下向きに傾斜する線です。次のグラフは、前述の軌跡を示しています。
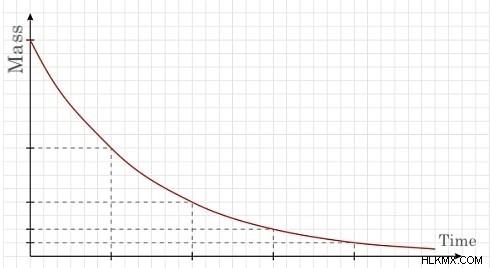
横軸の各境界点は半減期 (時間) を表し、Y 軸は元素の元のサンプルの質量 (グラム) を表します。上のグラフは半減期の軌跡のグラフを示していますが、同位体や元素によって半減期の長さが異なります。原子の安定性は、半減期の長さに影響します。
半減期の違い
半減期と原子の安定性の関係は、ジェンガ ゲームを使用して説明できます。

ジェンガ タワーに見られるさまざまなレベルの安定性。 (写真提供:Helga Khorimarko/Shutterstock)
タワーが安定しているほど、タワー内に存在するブロックの数が多くなります。同様に、原子が安定しているほど、元素の半減期は長くなります。
タワー内のジェンガピースの総数は、半減期の長さを表します。この類推は、より不安定になることが、半減期が短くなる (タワー内のブロックが少ない) ことに直接関係していることを示しています。
同位体と元素が異なれば、その安定性に基づいて半減期も異なります。次のグラフは、それぞれ 100 グラムの窒素 13、炭素 11、フッ素 18 の減衰速度の違いを示しています。
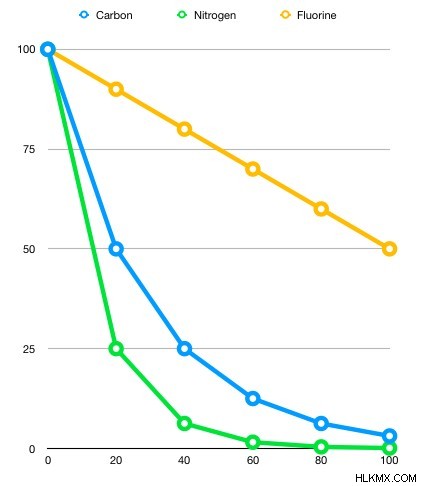
腐敗過程
このグラフから半減期がわかりますか?
20 分後、窒素サンプルの質量は 100 グラムから 25 グラムに減少しました。これは、このサンプルが 2 回の半減期を経験したことを示しています。一方、炭素 11 のサンプルは 20 分で半分になり、20 分がおおよその半減期であることを示しています。フッ素 18 のサンプルは 100 分で半分になり、半減期が 100 分であることを示唆しています。
この例では、さまざまな半減期の長さと、時間の経過に伴う減衰プロセスを示しています。半減期の長さは、数年から数秒までさまざまです。科学者は、10回の半減期を経験した後、元素サンプルは事実上「なくなった」と主張しています.
短い半減期 =存在しない要素?
特定の元素の半減期は非常に短いため、特定の元素の原子は非常に速い速度で放射性崩壊を経験し、急速に存在しなくなると考えるのが妥当です。これは気になるように見えるかもしれませんが、要素の半減期が非常に短い場合でも、要素が常に存在する理由は複数あります。
すべての元素には、半減期が異なる複数の同位体があります。元素の一部の同位体は半減期が短い場合がありますが、崩壊しないより安定した同位体が常に存在します。次の表は、炭素同位体のさまざまな半減期を示しています:
| 同位体 | 半減期 |
| カーボン 10 | 19 秒 |
| カーボン 11 | 20分 |
| カーボン 12 | 安定 |
| カーボン 13 | 安定 |
| カーボン 14 | 5700年 |
すべての元素は、炭素と同様の傾向に従います。同位体は半減期が短い場合がありますが、安定同位体は常に存在します。これにより、要素自体が存在しなくなることはありません。
元素が存在する傾向があるもう 1 つの理由は、ある同位体の崩壊が別の同位体の作成につながることです。同位体が放射性崩壊を受けると、原子核内の陽子と中性子の数が変化します。原子核内の陽子の数が変わると、別の元素の原子になります。たとえば、炭素 15 がベータ崩壊として知られる種類の崩壊を受けると、窒素 15 の同位体に変わります。この進行中のプロセスにより、同位体は同時に崩壊しながら形成されます。したがって、元素の同位体が崩壊して同じ元素の別の同位体を形成するとき、その元素はまだ存在します!
結論として、半減期がどれほど短くても、すべての元素には安定同位体があり、他の崩壊活動の結果として形成されることがよくあります。半減期がどれほど短くても、崩壊プロセスの速度により、要素が存在しなくなることは決してありません.







