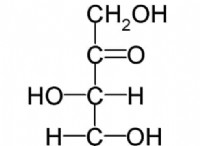
* 強い静電引力: イオン結合には、正に帯電した陽イオンと負に帯電した陰イオンとの間の強い静電引力が含まれます。この強い魅力は、克服するためにかなりの量のエネルギーを必要とし、高い融点をもたらします。
* クリスタル格子構造: イオン化合物は、剛性の3次元結晶格子構造を形成します。この配置は、イオン間の静電相互作用を最大化し、構造を非常に安定させ、破壊するのが困難になります。
例:
*塩化ナトリウム(NaCl)の融点は801°Cです。
*酸化マグネシウム(MGO)の融点は2852°Cです。
例外:
* イオンサイズが小さい: イオン半径が小さい(LICLのような)化合物は、静電引力が弱いため、わずかに低い融点を持つ可能性があります。
* 共有キャラクターの化合物: いくつかのイオン化合物は、ある程度の共有特性を示す可能性があり、イオン結合の強度を低下させ、融点を下げることができます。
一般に、イオン結合は、イオンを一緒に保持している強い静電力により、高い融点に関連しています。