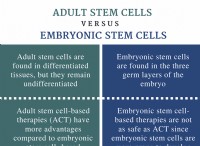
経験式
* 定義: 化合物中の原子の最も単純な全自由比。
* フォーカス: 化合物内の要素の相対的な割合を示します。
* 例: グルコース(C6H12O6)には、CH2Oの経験的式があります。
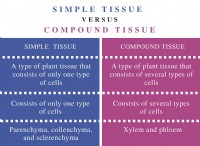
分子式
* 定義: 分子内の各元素の原子の実際の数。
* フォーカス: 分子の真の組成を表します。
* 例: グルコース(C6H12O6)には、C6H12O6の分子式があります。
重要な違い:
* シンプルさ: 経験式は最も単純化された表現であり、分子式は完全な組成を示しています。
* 一意性: 単一の分子式は一意の化合物を表しますが、複数の化合物は同じ経験式を共有できます。
* 情報: 分子式は、経験式よりも化合物の構造と特性に関するより多くの情報を提供します。
経験的式を決定する方法:
1。コンポーネート: 化合物内の各要素の割合の構成が必要です。
2。モルに変換: 各要素の原子量で各パーセンテージを分割して、各要素のモルを見つけます。
3。最も単純な比率を見つけます: すべてのモル値を最小モル値で除算して、最大の全自由比を取得します。
例:
化合物が40%の炭素、6.7%の水素、53.3%の酸素であるとしましょう。
1。モルに変換:
*炭素:(40% / 12.01 g / mol)=3.33モル
*水素:(6.7% / 1.01 g / mol)=6.63モル
*酸素:(53.3% / 16.00 g / mol)=3.33モル
2。最も単純な比率:
*最小値(3.33)で割る:
*カーボン:3.33 / 3.33 =1
*水素:6.63 /3.33≈2
*酸素:3.33 / 3.33 =1
経験的式はCh2o。です