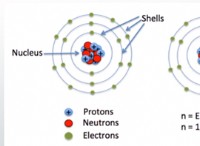
強酸
* 定義: 水中で完全にイオン化(バラバラ)し、すべての水素イオン(H+)を放出する酸。
* 例: 塩酸酸(HCl)、硫酸(H₂SO₄)、硝酸(HNO₃)
* 重要な特性:
*溶液中のH+イオンの高濃度。
*非常に低いpH(通常1未満)。
*塩基と激しく反応し、多くの熱を生成します。
*重度の火傷や皮膚やその他の材料に損傷を与える可能性があります。
強いベース
* 定義: 水中で完全に分離(分解)する塩基を使用して、すべての水酸化物イオン(OH-)を放出します。
* 例: 水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)、水酸化バリウム(BA(OH)₂)
* 重要な特性:
*溶液中のオハイオンの高濃度。
*非常に高いpH(通常13を超える)。
*酸と激しく反応し、多くの熱を生成します。
*重度の火傷や皮膚やその他の材料に損傷を与える可能性があります。
重要な違い:
* イオン化/解離: 強酸と塩基は溶液中に完全にイオン化/解離しますが、弱いものは部分的にしかそうしません。
* ph: 強酸は非常に低いpH値(酸性)ですが、強い塩基は非常に高いpH値(塩基性)です。
* 反応性: どちらも非常に反応性があり、互いに容易に反応して塩と水を形成します。
重要な注意: 強酸と塩基は強力ですが、濃縮酸や塩基と同じではありません。濃度とは、溶液中に存在する酸またはベースの量を指します。濃縮溶液には大量の酸または塩基がありますが、希釈溶液の量は少ないです。
これが類推です:
アスリートのチームを想像してください。強力なチームには、すべてのプレーヤーが完全に参加し、貢献しています。弱いチームでは、一部のプレイヤーがベンチに座っている可能性があります。 強酸と塩基は、それらの「オールイン」チームのようなものであり、イオンを溶液に完全に貢献しています。