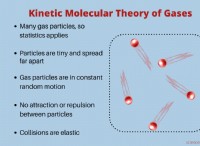
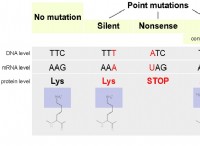
1。価電子の数を決定します:
* 硫黄: グループ16、したがって6価電子。
* 酸素(O): グループ16、したがって、それぞれ6つの原子価電子。 4つの酸素原子があるため、それは6 * 4 =24価電子です。
* チャージ: 2電荷は、2つの追加の電子を示します。
総価電子電子: 6 + 24 + 2 =32
2。 中央原子:
*硫黄は最小電気陰性原子であるため、中央に入ります。
3。単一債:
*各酸素原子を単一の結合(線で表す)で硫黄原子に接続します。これにより、8つの電子(4つの結合 * 2つの電子が1つあたり2つの電子)を使用します。
4。残りの電子を分配します:
*残り24個の電子が残っています(合計32個-8個が債券で使用されています)。
*これらの電子を酸素原子の周りに孤立したペアとして分布し、各酸素原子8電子を合計で与えます(それ自体の原子価シェル + 2から結合から2)。
5。二重結合:
*硫黄原子には周囲に6つの電子しかないことがわかります。
*オクテットのルールを満たすために、2つの酸素原子が硫黄と二重結合を形成します(2本の線で表されます)。これは、4つの電子(2つの結合 * 2つの電子1つの電子)を使用します。
6。 充電:
* 2電荷を表すには、2つの追加の電子を表示する必要があります。 酸素原子のいずれかに唯一のペアとして追加できます。
最終図:
これがドットとクロス図の表現です:
`` `
..
:O:
..
/ \
:S:
\ /
:O:
..
/ \
:O:
..
`` `
重要なメモ:
*ドットとクロス図は単純化された表現であり、硫酸イオンの真の形状を正確に描写していません。
*硫酸イオンの実際の形状は四面体であり、4つの酸素原子すべてが硫黄原子の周りに対称的に配置されています。