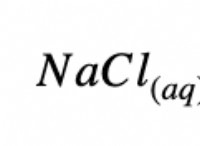* 両方とも強酸です: HClとHNO3の両方は強酸であり、溶液中に完全にイオン化することを意味します。これは、それらが主に水中にイオン(H+、Cl、およびNo3-)として存在することを意味し、個々の特性に基づいてそれらを区別することを困難にしています。
* 均質な混合物を形成します: どちらも水に非常に溶けやすいため、完全に混合して均一な溶液を形成します。これは、酸が溶液全体に均等に分布し、物理的な方法による分離が挑戦することを意味します。
ここに、酸を部分的に *分離する可能性のあるいくつかのアプローチがありますが、警告があります:
* 蒸留: 蒸留は沸点に基づいて混合物を分離するために使用できますが、HClとHNO3の沸点は比較的近いです。 これにより、完全な分離を達成することが困難になります。また、両方の酸は腐食性であり、プロセスは危険です。
* 選択反応: 他の酸を無傷のままにしながら、溶液からそれを除去する試薬で1つの酸を反応させることができます。たとえば、硝酸銀(Agno3)を追加して塩化物イオン(Cl-)を塩化銀(AgCl)として沈殿させることもできますが、これは硝酸酸からの硝酸イオン(NO3-)との反応にもつながります。この方法は部分的な分離のみを達成し、あまり効率的ではないかもしれません。
これらの酸を「分離」する最良の方法は、各酸の存在の溶液を慎重に分析することです。 これは、以下を含むさまざまな分析手法を通じて行うことができます。
* 滴定: 標準的なベースソリューションを使用して、酸を中和し、濃度を決定します。
* 分光測光法: 特定の波長での溶液の吸光度を測定します。これは、酸を識別および定量化するために使用できます。
* その他の分析方法: クロマトグラフィー、質量分析、または電気化学的手法などの技術を使用して、酸混合物を分離して分析できます。
重要な安全ノート: 強酸を扱うには、非常に注意が必要です。常に適切な保護具を着用し、換気の良いエリアで作業し、適切な取り扱い手順に従ってください。