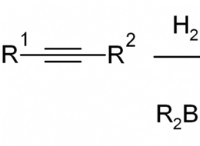イオン結合:
* 低イオン化エネルギー: 金属元素は比較的低いイオン化エネルギーを持っています。つまり、電子を容易に失い、正に帯電したイオン(陽イオン)を形成します。
* 静電引力: 金属によって形成されたカチオンは、非金属から負に帯電したイオン(アニオン)を強く引き付け、イオン化合物の形成につながります。
共有結合:
* 高い電気陰性度: 金属は、非金属と比較して電気陰性度が比較的低いです。電気陰性度とは、原子が結合中に電子を引き付ける能力です。これは、他の原子と電子を容易に共有しないことを意味します。
* 弱いオーバーラップ: 金属原子の軌道は、互いに貧弱に重なり合う傾向があります。この重複は、共有結合の形成に不可欠です。
共有結合があまり好まれていない理由:
* 強力な共有の欠如: 金属は、他の金属と等しく電子を共有する可能性が低く、結合が弱くなります。
* 金属結合: 共有結合を形成する代わりに、金属は金属結合を示すことがよくあり、そこでは電子が金属原子の格子にわたって非局在化されます。この非局在化は強い結合につながり、良好な導電性や順応性などの金属の特徴を説明します。
例外:
一般に金属はイオン結合を形成しますが、次のような共有結合を形成できるいくつかの例外があります。
* 金属製の結合: 一部の遷移金属は、水銀(Hg2^2+)や金属クラスター化合物の場合のように、互いに共有結合を形成できます。
* 有機金属化合物: 金属は、有機金属化合物の有機分子と共有結合を形成できます。
これらのポイントのいずれかの詳細が必要かどうかを教えてください!