二重結合は、2 対の電子が 2 つの原子間で共有されている化学結合です。このタイプの結合には、通常単結合に含まれる 2 つの結合電子ではなく、原子間に 4 つの結合電子が含まれます。二重結合は電子が多いため反応しやすい性質があります。二重結合は物理的に短く、単結合よりも比較的強力です。二重結合は、化学構造図で 2 本の平行線として描かれます。等号は、式で二重結合を表すために使用されます。ロシアの化学者アレクサンドル・バトレロフは、19 世紀半ばに構造式に二重結合を導入しました。この記事では、二重結合の概要について説明します。
二重結合の定義
共有すればするほど、あなたが強くなることは周知の事実です。少なくともあなたが原子であり、電子を共有しているなら、それは本当です!原子は最大 3 セットの電子を共有できます。 2 つの原子が 2 つの電子対を共有すると、二重結合が形成されます。
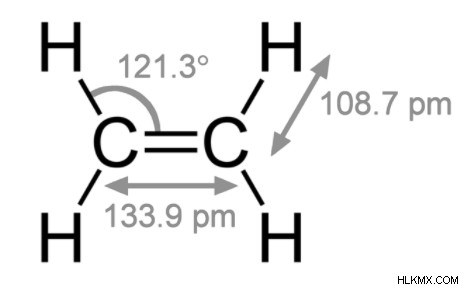
電子は常にペアで共有されます。各共有電子対は共有結合と呼ばれます。 2 つの共有電子は共有結合に対応します。 2 つの共有電子の 2 つのセットは、1 つの共有二重結合に相当します。合計 4 つの電子が二重結合で共有され、2 本の平行線で表されます。
二重結合の 2 つの原子は 4 つの電子を共有しているため、結合した原子を分離するには、単結合で結合した原子よりも多くのエネルギーが必要です。酸素原子間の二重結合を切断するのに必要なエネルギーは、酸素原子間の単結合を切断するのに必要なエネルギーの 3 倍です。窒素も同様です。二重結合を強くするメカニズムは、二重結合を短くします。二重結合炭素から別の炭素原子への平均結合長は、2 つの単結合炭素の平均結合長よりも 13% 短くなっています。
二重結合形成
オクテット規則に従うために、2 つの原子が 4 つの電子を共有しなければならない場合、二重結合が形成されます。オクテット規則によれば、原子は電子を失うか、獲得するか、または共有して、8 つの価電子を持ちます。二重結合は自然界で形成されることが多く、通常は炭素、窒素、酸素などの非金属でできています。二重結合がどのように形成されるかを理解するために、結合の構成要素である電子に何が起こるかを見てみましょう.
電子は原子の周りを不規則かつ急速に移動します。電子のエネルギーレベルと核への近さに応じて、電子は特定の形のままになります。電子が占める特定の形状は、電子軌道と呼ばれます。電子軌道には、s、p、d、および f の 4 つの形式があります。二重結合には、s 軌道と p 軌道が含まれます。
二重結合を形成するために、より多くの電子を放棄できる原子もあれば、より少ない電子を放棄できる原子もあります。原子がもたらすものは何でも、原子は利用可能な電子の周りを移動して、4 つの電子を共有できるようにする必要があります。
各原子は、最初に最も外側の s 軌道と p 軌道を結合して sp 軌道を形成する必要があります。この混成軌道には 2 つの電子が含まれます。各原子の sp 軌道は重なり合うため、各原子は両方の電子にアクセスできます。このような結合はシグマ結合と呼ばれます。各原子は、残りの 2 つの p 軌道の 1 つを使用して、2 つの電子を他の原子と共有します。重なり合うp軌道で共有される電子は、パイ結合と呼ばれます。二重結合は、1 つの σ 結合と 1 つの π 結合を示します。
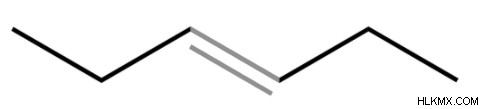
二重結合の例
エチレン (C2H4) は、2 つの炭素原子の間に二重結合を持つ炭化水素です。他のオレフィンも二重結合を含んでいます。二重結合は、イミン (C=N)、スルホキシド (S=O)、およびアゾ化合物 (N=N) で観察されます。
一重結合、二重結合、三重結合の違いは次のとおりです:
<オール>定義:
単結合:単結合は、一対の価電子を共有することによって発生します。
二重結合:二重結合は、2 対の価電子を共有することによって発生します。
三重結合:三重結合は、3 対の価電子を共有することによって発生します。
-
反応性:
単結合:単結合は反応性が低い.
二重結合:二重結合は適度に反応性があります。
トリプル ボンド:3 つのキーは非常にきびきびしています。
-
バインディングの長さ:
単結合:単結合は長い結合長を持っています.
二重結合:二重結合には平均結合長があります。
三重結合:三重結合の結合強度は低い.
-
指示者:
単一結合:単一キーは単一ダッシュ (CC) で表されます。
二重結合:二重結合は、2 つの平行なダッシュ (C=C) で表されます。
三重結合:三重結合は、3 つの平行なダッシュ (C≡C) で表されます。
例:
<オール>単結合:メタン、エタン、プロパン、ブタンなどのアルカンなど
二重結合:エチレン、プロピレン、カルボニル (C=O)、アゾ化合物 (N=N)、イミン (C=N)、スルホキシド ( S=O).
三重結合:窒素 (N≡N)、シアン化物イオン (C≡N)、アセチレン (CH≡CH)、一酸化炭素 (C≡O) など).
結論
通常の電子対ではなく、2 つの電子対が 2 つの原子間で共有される共有結合で、最も一般的には炭素と炭素、酸素、または窒素原子の間で共有されますが、他のいくつかの形態が知られています。それらを接続する原子に関係なく、すべての二重結合は、1 つのシグマ結合と 1 つのパイ結合で構成されます。この二重結合の軌道ビューは、有機化合物のこのレベルでのみ本当に重要です。詳細については、下の最初のリンクをクリックしてください。オーガニック リンク専用のセクションを含むメニューが表示されます。エチレンの説明が繰り返されていますが、ベンゼンの結合と炭素-酸素二重結合に関する情報も見つかります。