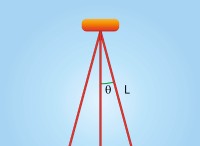
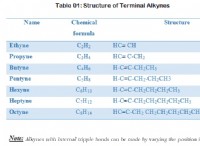
gaseous hcl:共有結合
* 電気陰性の差: 水素(2.1)と塩素(3.0)の電気陰性の差は比較的小さい(0.9)。この違いは、電子の完全な伝達を作成するほど大きくなく、イオン結合につながります。
* 極性共有性: 完全にはイオンではありませんが、電気陰性度の違いは極性の共有結合を生み出します。塩素は共有電子をより強く引き付け、分子の水素端をわずかに陽性(Δ+)にし、塩素末端はわずかに陰性(Δ-)にします。
* イオン化なし: 気体状態では、HClは個々の分子として存在します。分子はイオン化を引き起こす方法で相互作用していないため、遊離イオンは存在しません。
水性Hcl:イオン挙動
* 溶媒和: HClガスが水に溶解すると、水分子はHCl分子と相互作用します。高極水分子はHCl分子を囲み、共有結合を弱めます。
* イオン化: 極水分子は、HClの部分的に陽性の水素原子に強い引っ張りを行います。このプルは、共有結合を破るのに十分な強さであり、その結果、H+およびCl-イオンが形成されます。
* 水分補給: 次に、H+およびCl-イオンは水分子(水分補給)に囲まれ、溶媒和イオン溶液を形成します。この水分補給プロセスは、イオンを安定させ、それらが再結合するのを防ぎます。
要約:
重要な違いは、水溶液中の水分子の存在です。水の強い極性とイオンを溶媒和する能力は、HClの共有結合を破壊し、イオンの形成につながります。ガス状の状態では、水の影響がないため、HCLはその主に共有特性を保持します。