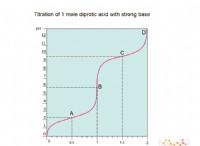
その理由は次のとおりです。
* 強酸と塩基は溶液中に完全に解離します。 これは、彼らが完全にイオンに分解することを意味します。たとえば、HCl(強酸)はH+およびCl-イオンに分離し、NaOH(強い塩基)はNa+およびOh-イオンに解離します。
* 中和反応には、水の形成が含まれます。 酸からのH+イオンは、塩基からのオハイオンと反応して水(H2O)を形成します。
* 中和のエンタルピー変化は、本質的にH+とOHIONの間の反応のエンタルピー変化です。 この反応は、使用される特定の強酸と強い塩基に関係なく、本質的に同じです。
重要な考慮事項:
* 中和のエンタルピーの変化は、特定の酸と塩基によってわずかに異なる場合があります。 これは、イオンの水和やイオン相互作用などの要因によるものです。
* 中和のエンタルピー変化は負です。 これは、反応が発熱性であり、周囲に熱を放出することを意味します。
例:
塩酸ナトリウム(HCL)と水酸化ナトリウム(NAOH)の中和反応は、次のように表現できます。
HCl(aq) + naoh(aq)→naCl(aq) + h2o(l)
この反応のエンタルピー変化は約-57.1 kJ/molであり、57.1 kJの熱が形成されたモルあたり放出されていることを示しています。