1。電気陰性度:
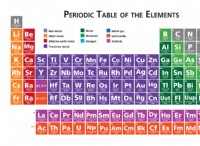
* 重要な概念: 電気陰性度は、結合中に電子を引き付ける原子の能力の尺度です。電気陰性度が高いほど、共有電子の引きが強くなります。
* トレンド: 電気陰性度は、期間(左から右)にわたって増加し、周期表のグループ(上から下)を減少させます。
* 例: 酸素(O)は炭素(C)よりも電気陰性であり、これは水素(H)よりも電気陰性です。
2。電気陰性度の比較:
* 違いを見つけます: 結合内の他の原子の電気陰性度から水素(2.1)の電気陰性度を減算します。
* より大きな差=より多くの負の電荷: 電気陰性度の違いが大きい原子は、電子により強い引っ張りをもたらし、より負の部分電荷(Δ-)になります。
例:
h₂o(水)とch₄(メタン)の結合を比較しましょう。
* h₂o: 酸素(O)の電気陰性度は3.5です。 違いは3.5-2.1 =1.4です。
* ch₄: 炭素(c)の電気陰性度は2.5です。違いは2.5-2.1 =0.4です。
結論: 電気陰性度の違いが大きいため、水中の酸素はメタンの炭素よりも負の部分電荷(Δ-)を持ちます。
重要な注意:
* 極性共有結合: 電気陰性度の違いが重要な場合、結合は極性共有結合と見なされます。これは、分子内に電荷の分離があり、一方の端がわずかに陰性になり、もう一方の端がわずかに陽性になることを意味します。
* 非極性共有結合: 電気陰性度の差が非常に少ない(ゼロに近い)場合、結合は非極性共有結合と見なされます。電子は原子間でより均等に共有されます。
別の例を試してみたい場合はお知らせください!