溶解とイオン化:
1。極性: 極性共有化合物は、分子内で異なる電荷の分離を持っています。分子の一方の端はわずかに正(Δ+)であり、もう一方の端はわずかに負(Δ-)です。
2。溶媒としての水: 水も極性分子です。極性共有化合物が水に溶けると、水分子の正の端が溶質分子の負の端に引き付けられ、逆も同様です。水分子と溶質分子の間のこの強い魅力は、溶質分子を保持する力を克服します。
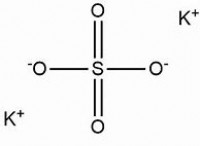
3。イオン化: 水分子との強い相互作用により、極性共有化合物がその構成イオンに分解される(イオン化)する可能性があります。たとえば、極性共有化合物であるテーブルソルト(NaCl)を検討してください。水に溶けると、水分子とNa+およびCl-イオンの間の強い引力により、イオン結合が壊れ、溶液中の遊離Na+およびCl-イオンが生じます。
導電率:
* 遊離イオン: 溶液中に遊離イオンが存在すると、溶液が電気を導入できます。これらのイオンは、電荷を運ぶ溶液全体で自由に移動できます。
* 電荷の流れ: 溶液全体に電位が適用されると、陽イオンは負の電極(カソード)に向かって移動し、負イオンは正の電極(アノード)に向かって移動します。この電荷の動きは、電流を構成します。
例:
* テーブルソルト(NaCl): 水に溶解すると、NaClはNa+およびCl-イオンにイオン化し、溶液を導電性にします。
* 砂糖(C12H22O11): 砂糖は極性共有化合物ですが、水ではイオン化しません。したがって、砂糖溶液は電気を導入しません。
要約すると、極性共有化合物は水分子と溶質分子の間の強い引力が溶質を壊し(イオン化)荷電イオンに分解し、溶液中に自由に移動し、電流を運ぶ可能性があるため、それらの水形で電気を導くことができます。