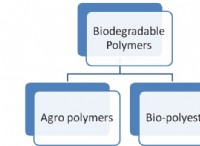
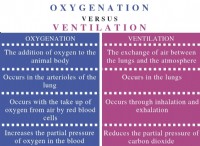
中和プロセス
中和は、酸と塩基が塩と水を形成するために反応する化学反応です。それは化学の基本的な概念であり、次のようなさまざまな分野で幅広い用途があります。
* 化学: 酸塩基反応とpHの変化を理解する。
* 生物学: 生物系のpHバランスを維持します。
* 環境科学: 酸性廃水と土壌修復の治療。
* 業界: 塩およびその他の化学物質の生産。
中和の重要な特性:
* 酸 +ベース→塩 +水
* 熱の放出(発熱反応)
* 溶液のpHはニュートラルに向かって移動します(pH 7)
例:塩酸と水酸化カリウム
塩酸酸(HCl)は強酸であり、水酸化カリウム(KOH)は強力な塩基です。これら2つが反応すると、互いに中和し、塩化カリウム(KCL)と水(H₂O)を生成します。
hcl(aq) + koh(aq)→kcl(aq) +h₂o(l)
説明:
* hcl: プロトン(H+)を寄付して、H₃O+(ハイドロニウムイオン)を形成します。
* koh: プロトン(H+)を受け入れてOH-(水酸化物イオン)を形成します。
* h₃o+およびoh-結合して水を形成する(h₂o)。
* k+およびcl-塩化カリウム(KCl)として溶液中に残っています。
反応は発熱性であり、つまり、プロセス中に熱が放出されます。溶液のpHは、強酸と塩基が中和されるため、中性(pH 7)に向かって移動します。
注: 反応は、水が反応物と生成物の溶媒として機能するため、水溶液(AQ)で実行されます。水の状態は、製品として形成されているため、液体(L)です。
この例は、中和の基本原則を強調しています。強酸と強力なベースの間の反応は、同様の特性を持つ塩と水を生成します。