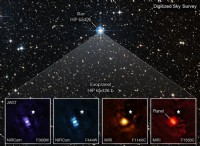
* イオン結合 金属と非金属の間に形成されます。
* 金属 電子を簡単に失う傾向があり、積極的に帯電したイオン(陽イオン)になります。
* 非金属 電子を簡単に獲得し、負に帯電したイオン(アニオン)になる傾向があります。
*反対に帯電したイオン間の強い静電引力は、化合物を一緒に保持します。
例:
* 塩化ナトリウム(NaCl) :ナトリウム(Na)は1つの電子を失い、Na+カチオンになり、塩素(Cl)はその電子を獲得してCl-陰イオンになります。これらの反対に帯電したイオン間の強い魅力は、NaClのイオン結合を形成します。
対照的に、共有結合には2つの非金属原子間の電子の共有が含まれます。