so 2 (g) + h 2 o(l)⇌H 2 so 3 (aq)
これが何が起こるかの内訳です:
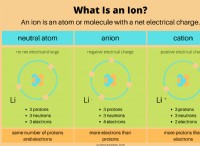
* 二酸化硫黄(so 2 ) 刺激的な臭いを持つ無色のガスです。
* 水(H 2 o) 溶媒として機能する液体です。
* 硫酸(H 2 so 3 ) 主に溶液に存在する弱酸です。不安定で、二酸化硫黄と水に分解します。
重要なポイント:
* 反応は可逆的です: これは、硫酸が二酸化硫黄と水に再び分解できることを意味します。
* 硫酸は弱酸です: 溶液中に部分的にのみイオン化します。つまり、すべての水素イオン(H+)を放出するわけではありません。
* 酸性雨には反応が重要です: 化石燃料が雨水に溶けて硫酸を形成するなど、供給源から大気中に放出される二酸化硫黄。これは雨の酸性度に寄与し、環境に有害な影響を与える可能性があります。
全体として、二酸化硫黄と水の間の反応は、酸性雨に寄与する弱酸硫酸の形成をもたらします。