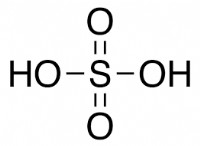
これが故障です:
酸:
* 強酸 溶液中に完全にイオン化します。つまり、すべての水素イオン(H+)を溶液に寄付します。例には、塩酸(HCl)、硫酸(H₂SO₄)、および硝酸(HNO₃)が含まれます。
* 弱酸 溶液中に部分的にのみイオン化します。つまり、水素イオンの一部のみを寄付します。例には、酢酸(Ch₃COOH)、炭酸酸(H₂CO₃)、およびフルオリ酸(HF)が含まれます。
ベース:
* 強いベース 溶液中に完全に解離します。つまり、すべての水酸化物イオン(OH-)を溶液に放出します。例には、水酸化ナトリウム(NaOH)および水酸化カリウム(KOH)が含まれます。
* 弱いベース 溶液中に部分的にのみ解離します。つまり、水酸化物イオンの一部のみを放出します。例には、アンモニア(NH₃)、炭酸塩イオン(Co₃²⁻)、および重炭酸イオン(HCO₃⁻)が含まれます。
強度に影響する要因:
* 結合強度: 水素原子と分子の残りの部分との間の強い結合により、H+イオンを放出するのが難しくなり、酸が弱くなります。同様に、水酸化物イオンと分子の残りの部分との間の強い結合は、より弱い塩基を示します。
* 極性: より多くの極性分子は、H+イオン(酸の場合)を寄付したり、H+イオン(塩基用)を受け入れたりするのに優れており、より強力な酸または塩基強度につながります。
* 共鳴および誘導効果: これらの要因は、酸のコンジュゲートベースまたは塩基の共役酸の安定性に影響を与える可能性があり、酸または塩基の強度に影響します。
酸と基底強度の測定:
* 酸解離定数(KA): KA値が高いほど、酸が強いことを示します。
* ベース解離定数(KB): KB値が高いほど、より強いベースが示されます。
要約:
酸または塩基の強度は、溶液中の陽子(H+)をどれだけ容易に寄付または受け入れるかによって決まります。強酸と塩基は完全にイオン化しますが、弱酸と塩基は部分的にしかイオン化しません。結合強度、極性、共鳴、誘導効果などの要因は、イオン化プロセス、したがって酸または塩基の強度に影響します。