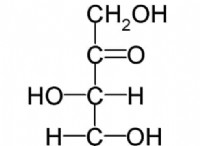
1。蒸留:
* 原則: この方法は、酸とアルコールの沸点の違いに依存しています。一般的に、酸はアルコールよりも高い沸点を持っています。
* 手順: 混合物を優しく加熱します。沸点が低いアルコールは最初に蒸発し、別の容器に収集できます。酸は元の容器に残ります。
* 制限: この方法は、沸点の大きな違いがある混合物に適していますが、沸点が近すぎる場合は効果的ではない場合があります。
2。抽出:
* 原則: この方法では、一方のコンポーネントが他のコンポーネントよりも優先的に溶解する溶媒を使用します。
* 手順: 混合物に適切な溶媒(たとえば、ジエチルエーテルのような非極性溶媒)を追加します。アルコールは溶媒に溶解し、酸は元の相に残ります。その後、2つのフェーズを分離し、溶媒からアルコールを回収できます。
* 制限: この方法では、特定の酸とアルコールの特性に基づいて溶媒を慎重に選択する必要があります。
3。ベースとの反応:
* 原則: この方法は、酸の酸性の性質を活用します。水酸化ナトリウム(NAOH)のような強い塩基を使用して酸を中和し、アルコールから分離できる塩を形成することができます。
* 手順: 混合物に強いベースを追加します。酸は塩基と反応し、塩(通常は水溶性です)を形成します。その後、ろ過または他の適切な技術によってアルコールを塩から分離できます。
* 制限: 一部の方法は強い塩基と激しく反応する可能性があるため、この方法はすべての酸に適していません。
4。クロマトグラフィー:
* 原則: この方法は、定常期と移動相に対する親和性に基づいてコンポーネントを分離します。
* 手順: 混合物はクロマトグラフィーカラムまたはプレートに適用され、コンポーネントは、定常段階と携帯電話の異なる親和性に基づいて分離されます。
* 制限: クロマトグラフィーは複雑で時間のかかるプロセスになる可能性がありますが、複雑な混合物を分離するのに非常に効果的です。
例:
酢酸(CH3COOH)とエタノール(CH3CH2OH)の混合物があるとしましょう。酢酸はエタノール(78°C)よりも高い沸点(118°C)を持っているため、蒸留によってそれらを分離できます。また、ジエチルエーテルのような溶媒で抽出を使用することもできます。
重要な考慮事項:
* 安全性: 常に慎重に化学物質を扱い、適切な安全手順に従ってください。
* 特定のプロパティ: 最良の分離方法は、関与する酸とアルコールの特定の特性に依存します。
* 純度: 選択した分離方法が、目的の純度レベルを取得するのに適していることを確認してください。
特定の酸とアルコールを使用している場合は、特定のガイダンスについては、化学リファレンスブックまたは専門家に相談することをお勧めします。