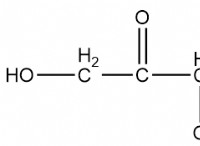
* 電子構成:
*酸素(O)には8つの電子があり、構成1S²2S²2ppがあります。これは、2つの電子シェルがあることを意味します。
*硫黄には16個の電子があり、構成1S²2S²2p⁶3S²3p⁴があります。 3つの電子シェルがあります。
* 原子半径:
*原子のサイズは、その核と最も外側の電子シェルの間の距離によって決定されます。
*硫黄には酸素と比較して追加の電子シェルがあるため、その最も外側の電子は核からさらに遠く、その原子半径が大きくなります。
簡単に言えば: 電子シェルが核の周りの同心円として想像してください。硫黄にはより多くの円があるため、その最も外側の円は中心から遠く離れています。
その他の要因:
* 核電荷: 硫黄にはより大きな核電荷(より多くの陽子)がありますが、この効果は電子シェルの数の増加により上回り、より大きな原子半径につながります。
重要な注意: 硫黄は原子半径の点で酸素よりも大きいが、原子サイズは特定の化学環境(たとえば、原子が分子で結合されている場合)によって異なる場合があることを覚えておくことが重要です。