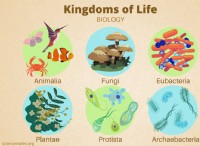
その理由は次のとおりです。
* 質量保存法則: この法律は、閉じたシステムでは、化学反応前の反応物の総質量は、反応後の産物の総質量に等しくなければならないと述べています。プロセス中に質量が失われたり、獲得されたりすることはありません。
* バランス化学式: 化学式のバランスをとると、係数(化学式の前の数値)を調整して、反応物側(左側)の各元素の原子数が製品側(右側)のその要素の原子数に等しくなるようにします。
例:
メタンの燃焼:
不均衡: CH4 + O2→CO2 + H2O
バランス: CH4 + 2O2→CO2 + 2H2O
説明:
*不均衡な方程式では、反応物側に1つの炭素(C)、4つの水素(H)、および2つの酸素(O)原子がありますが、生成物側には1つの炭素、2つの酸素、および2つの水素原子のみがあります。
* O2の前に係数「2」とH2Oの前に「2」を追加することにより、両側に各原子タイプの数が同数になります。
* 1つの炭素、4つの水素、4つの酸素が両側に。
したがって、方程式のバランスをとると、反応物の総質量(CH4およびO2)が産物の総質量(CO2およびH2O)に等しくなり、質量の保存法則が満たされます。