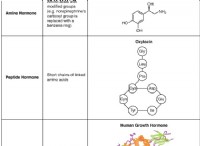
1。化学構造:
* 水素イオンの存在(H+): 酸には常に、水に溶解すると水素イオン(H+)として簡単に放出できる水素原子が含まれています。これは酸の決定的な特徴です。
* 電気陰性原子の存在: 酸はしばしば、酸素、塩素、窒素などの電気陰性原子を含んでいます。この原子は電子をそれ自体に引き付け、水素原子と電気陰性原子の間の結合を弱くし、水素イオンをより簡単に放出できるようにします。
2。解決策の動作:
* 水中の水素イオン(H+)の濃度を増加させる: 酸を水に溶けると、水素イオン(H+)が放出されます。これにより、溶液中のH+イオンの濃度が増加し、酸性になります。
* 低pH: 酸のpH値は低く、通常は7未満です。PHスケールは、溶液の酸性度またはアルカリ度を測定します。
酸の例:
* 塩酸(HCl): この強酸には、高陽性塩素原子に結合した水素原子が含まれています。水に溶解すると、水素イオンを容易に放出します。
* 酢酸(CH3COOH): この弱酸は酢に含まれています。酸素原子に取り付けられた水素原子を含むカルボキシル基(-COOH)を含み、これを水素イオンとして放出できます。
* クエン酸(C6H8O7): この弱酸は柑橘類に含まれています。酸性の性質に寄与する複数のカルボキシル基があります。
要約すると、酸は水に溶解すると水素イオン(H+)を放出し、溶液中のH+イオンの濃度を増加させる物質です。これにより、pH値が低く酸性特性が生じます。