Gay-Lussac の法則では、「一定の体積では、ガスの圧力は絶対温度 (ケルビン) に正比例する」と述べています。
すべてのエアゾール缶には、「日光から保護し、50°c を超える温度にさらさないでください」という警告ラベルが付いています。エアゾール缶が高温にさらされると、内部のガスの圧力が上昇します。しばらくすると、容器が高圧ガスを保持できなくなり、最終的に爆発するポイントに到達します。
エアゾール缶が爆発するのは、ガスの圧力と温度が密接に関係しているためです。ゲイ・リュサックの法則は、ガスの温度と圧力の間のこの関係を表しています。
ゲイ リュサックの法則
ゲイ・リュサックの法則は、「体積が一定に保たれている場合、理想気体の圧力はその絶対温度に正比例する」と述べています。この法則は、数学的に次のように表されます。
P∝T
P =kT
ここで、P はガスの圧力で、通常は atm または mm Hg で測定されます。T はガスの絶対温度 (ケルビン) で、k は比例定数です。

キャプテン・アメリカとバッキーは別として、プレッシャーと温度が真の友情の目標です。
法則を完全に理解するために、ガスの温度と圧力がどのように定義され、測定されるかを見てみましょう。
気体の運動理論では、温度を気体分子の平均運動エネルギーと定義しています。この理論では、気体は一定の運動状態にある微細な粒子 (単原子気体の場合は原子、2 原子気体の場合は分子) の集まりであると想定しています。モーションは完全にランダムで、速いペースで進行します。また、粒子は、粒子が含まれているコンテナの壁と相互に衝突し続けると想定されています。

気体の分子は一定のランダムな運動状態にあり、容器の壁に衝突すると仮定されます。 (写真提供:A.グレッグ/ウィキメディア・コモンズ)
単一分子の運動エネルギーは、その質量と速度の 2 乗の積の半分として与えられます (K.E =mv2/2)。温度は分子の平均並進運動エネルギーの尺度として定義されるため、ガスの分子の温度と運動は互いに比例します。
T ∝ mv2/2
ここで、T は温度、m は単一分子の質量、v はその運動速度を表します。
分子の質量は一定であるため、運動エネルギーは、分子の速度が増加した場合にのみ増加します。したがって、温度の上昇は分子の速度の増加につながります。高温ガス中の分子は、低温ガス中の分子と比較してより速い速度で移動します。
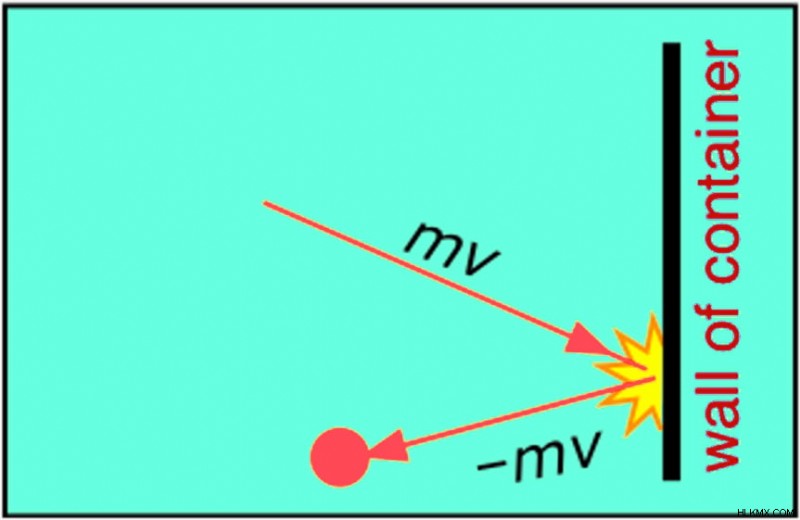
ガス分子は容器の壁に mv の運動量で衝突します (m は分子の質量、v はその速度)。負の符号は、壁に衝突した後、分子が同じ速度で反対方向に跳ね返ることを意味します。
一方、圧力は、容器の壁のガス分子によって面積あたりに適用/実行される力として定義されます。温度が上昇すると、分子が容器の壁に衝突する速度も上昇します。したがって、温度とともに、ガス分子によって容器の壁に加えられる力と、衝突の頻度、つまり圧力も増加します。
2 つの異なる州での同じガスに対するゲイ・リュサックの法則は、次のように与えられます。
P1/P2 =T1/T2
P1.T2 =T1.P2
ゲイ・リュサックの法則の適用
ゲイ・リュサックの法則は、日常の多くの活動で実際に見られます。これらの例には、圧力鍋の作動、夏のタイヤの爆発、銃やエアゾール缶などの発砲ツールが含まれます。
タイヤの爆発は夏によく見られます。実際、夏のタイヤの爆発は非常に頻繁に発生するため、5 月から 10 月までの期間はパンク シーズンと呼ばれます。爆発は、タイヤと路面の間の摩擦によって引き起こされる熱の蓄積によって発生します。夏の間、道路に敷かれたアスファルトはすでに非常に高温になっており、これがジレンマをさらに悪化させます。
摩擦により、タイヤ (ゴムでできているため、熱の良導体) の温度が上昇し、その結果、タイヤ内の空気の温度も上昇します。ゲイ・リュサックの法則で説明されているように、空気の温度が上昇すると気圧が上昇します。圧力の上昇は、空気の体積の増加も伴います。最終的には、エアゾール缶と同じように、タイヤが高圧の空気と内部の膨張する空気の量を保持できなくなり、爆発するポイントに到達します。
ゲイ・リュサックの法則の歴史
温度と圧力の関係は、フランスの物理学者ギヨーム・アモントンによって最初に注目されました。 Amontons が導き出した結果と結論は、部分的にしか正しくありませんでしたが。サンプルガスとして空気を使用した彼の研究と実験により、ガスの圧力は冷水と沸騰水の温度の間で約 3 分の 1 増加すると結論付けました。
不正確さは、正確な温度計が利用できないために発生しました。アモントンはまた、温度が十分に下がるとガス圧が完全になくなるという仮説を立てました。
100 年以上後の 1802 年頃、ジョセフ ルイス ゲイ リュサックは、気体のマクロ特性 (体積 v、温度 T、圧力 p、粒子数 n) に関する研究を発表しました。 Gay-Lussac は、気温計の開発中に法律に出会いました。
圧力と温度の関係とともに、ゲイ=リュサックは別の法則を述べました。彼は、「圧力が一定の場合、理想気体の体積はその絶対温度に正比例する」と述べました。ただし、この法則はチャールズの法則として知られています。ジャック・シャルルも同様の結論に達したが、それを公表しなかったため、ゲイ・リュサックは謙虚にチャールズに当然のクレジットを与えた.
結論
圧力と温度の関係はアモントンによって最初に発見されたため、現在では一般にアモントンの法則として知られています。ゲイ・リュサックの名前は、彼が発見した別の法律に関連付けられています。この法則は結合ガスの法則と呼ばれ、反応ガスとそのガス生成物の比率を整数で表す方法を説明しています。ただし、一部の化学および物理学の学術書では、圧力と温度の関係をゲイ-リュサックの法則と見なし続けています。







