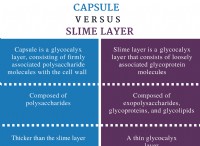
2 hcl(g)⇌Hh₂(g) +cl₂(g)
この反応は、塩化水素(HCl)の水素ガス(H₂)および塩素ガス(Cl₂)への分解を表しています。
Keqを決定する方法は次のとおりです。
1。 Keq の理解
Keqは、平衡状態での産物に対する生成物の比率であり、各濃度はバランスのとれた化学式における化学量論係数の能力に上昇します。
上記の反応について:
keq =[h₂] [cl₂] / [hcl]²
どこ:
* [H₂]は、水素ガスの平衡濃度です
* [cl₂]は、塩素ガスの平衡濃度です
* [HCl]は、塩化水素の平衡濃度です
2。 keq の決定
KEQを計算するには、すべての反応物と生成物の平衡濃度が必要です。この情報は、平衡状態でガスの部分圧を測定するなど、実験的に取得できます。
3。 Keq の重要性
Keqは、反応が進行する程度に関する貴重な情報を提供します。
* 大きなkeq: 反応が製品の形成を強く支持することを示します。
* 小さなkeq: 反応が反応物を好むことを示します。
重要な注意:
* KEQの値は、特定の温度に固有です。
* Keqは、反応が平衡に達する速さを教えてくれません。それは、平衡状態の反応物と産物の相対的な量をあなたに伝えるだけです。