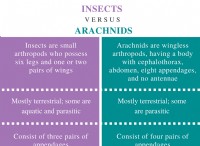
説明:
* 酸強度: 酸の強度は、酸性陽子(H+)を寄付する酸の能力によって決定されます。酸が強いほど、陽子をより容易に寄付します。
* 酸強度に影響する要因:
* 中央原子の電気陰性度: 中央原子が電気陰性であるほど、電子をO-H結合から引き離すことができ、プロトンを放出しやすくなります。
* コンジュゲートベースの安定性: より安定したコンジュゲートベースは、酸を強くします。
* 比較:
* hclo4: HCLO4の塩素原子は、H2SO4の硫黄よりも電気陰性です。 さらに、過塩素酸イオン(ClO4-)は、負電荷の共鳴非局在化により、非常に安定した陰イオンです。これらの要因は、HCLO4が非常に強酸であることに貢献しています。
* H2SO4: 硫酸は強酸ですが、乳酸ほど強くありません。硫黄原子は塩素よりも電気陰性ではなく、硫酸イオン(SO42-)も過塩素酸イオンよりも安定性が低い。
結論:
塩素の電気陰性度が高いため、過塩素酸イオンの安定性が高いため、 Hclo4はH2SO4よりも強い酸です。