1。電子構成:
*原子は、通常は電子の完全な外殻を持つ安定した電子構成を努力します。
*通常、周期表の右側にある非金属は、この安定性を実現するために電子を獲得する傾向があります。
*これを達成するために、原子は電子を獲得または失う(イオン結合)または電子を共有する(共有結合)。
2。電子の共有:
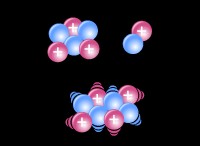
*共有結合では、2つ以上の原子が共有 完全な外側シェルを実現するための価数(最も外側)電子。
*各共有電子ペアはA 共有結合を形成します 、これは原子間の強い魅力です。
*この共有電子のペアは、両方の原子の電子数に向かってカウントされ、安定性が達成されます。
3。共有結合の種類:
* 単一の共有結合: 1つの電子が2つの原子間で共有されます。
* 二重共有結合: 2組の電子が2つの原子間で共有されます。
* トリプル共有結合: 3組の電子が2つの原子間で共有されます。
4。例:水分子の形成(H₂O):
*酸素(O)には6つの価電子があり、完全なオクテットを達成するためにさらに2つ必要です。
*水素(H)には1つの原子価電子があり、完全なデュエットを達成するためにさらに1つが必要です。
*各水素原子は、その単一電子を酸素と共有し、2つの単一共有結合を形成します。
*現在、酸素には外側のシェルに8つの電子があり(各水素から共有された2つ)、各水素には外殻に2つの電子があります(酸素から共有)。
5。極性共有結合:
*異なる電気陰性度(電子を引き付ける能力)を持つ2つの原子が電子を共有すると、共有電子はより多くの電気陰性原子に向かってさらに引っ張られます。
*これにより、A 極性結合結合が生じます 、分子の一方の端にはわずかに負の電荷があり、もう一方の端にはわずかに正電荷があります。
要約:
共有結合は、原子が電子を共有して安定した電子構成を実現するときに形成されます。共有された電子の数は、結合のタイプ(単一、二重、またはトリプル)を決定します。共有電子の分布は、多くの分子のユニークな特性に寄与する極性共有結合を作成できます。