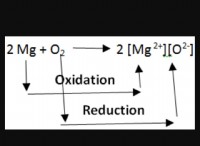
その理由は次のとおりです。
* boron(b) 3つの原子価電子を備えたメタロイドです。
* フッ素(f) 7つの原子価電子を持つ非常に陰性ハロゲンです。
安定したオクテット構成を実現するために、ボロンはさらに3つの電子を必要とし、フッ素はもう1つ必要です。トリフッ化ホウ素は、それぞれ3つのフッ素原子がホウ素と1つの電子を共有し、共有結合をもたらすと形成されます。
トリフッ化ホウ素の重要な特性:
室温でのガス: Bf₃は、刺激的な臭いを持つ無色の有毒ガスです。
* 強いルイス酸: それはルイス酸として機能し、ホウ素原子の周りの電子欠乏のために電子ペアを容易に受け入れます。
* 重要な工業化学物質: BF₃は、以下を含むさまざまなアプリケーションで使用されます。
* 有機合成: フリーデルクラフトのアルキル化やアシル化などの反応の触媒として。
* 半導体産業: シリコンウェーハ生産のドーパントとして。
* 重合: 特定のポリマーの生産における触媒として。