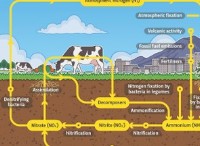
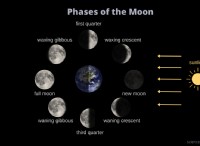
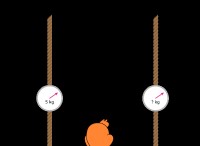
鉛ジコリド(PBCL2):
* イオン結合: PBCL2では、鉛(PB)と塩素(CL)の電気陰性度の違いは、結合をほとんどイオンと考えるのに十分な大きさです。鉛は2つの電子を+2陽イオン(pb²⁺)に失い、塩素は1つの電子を獲得して-1アニオン(Cl⁻)になります。これらの反対に帯電したイオン間の強い静電引力は、イオン化合物の形成につながります。
四塩化鉛(PBCL4):
* 共有結合: PBCL4では、鉛と塩素の電気陰性度の違いは依然として重要ですが、PBCL2ほど劇的ではありません。 鉛は依然として電子を失う傾向がありますが、塩素原子の数が多いことは、原子間で電子密度がより均等に共有されることを意味します。この電子の共有は、共有結合をもたらします。
結合タイプに影響する重要な要因:
* 電気陰性の差: 2つの原子間の電気陰性度の違いが大きいほど、結合がイオン性になる可能性が高くなります。
* リガンドの数: 周囲の原子(リガンド)の数も役割を果たすことができます。 PBCL4では、4つの塩素原子が鉛原子の正電荷をより安定させることができ、結合をより共有結合にします。
概要:
*塩化鉛化合物の結合は、鉛と塩素の電気陰性度の違い、および存在する塩素原子の数の影響を受けます。
* PBCL2は、主に大きな電気陰性の違いとより単純な構造のためにイオン結合を示します。
* PBCL4は、電気陰性度の差が小さく、4つの塩素原子の存在により、主に共有結合を示します。
他に質問がある場合はお知らせください!