正式な区別についてはまだいくつかの議論がありますが、分子は化学結合によって結合された 2 つ以上の原子のグループであり、化合物は存在する複数の種類の元素の化学結合によって形成される物質です。一定の割合。分子化合物とイオン化合物は、それぞれに含まれる結合の種類が異なります。
目を閉じて高校の科学を思い出すと、化学の授業で先生が絶え間なく分子や化合物について話し合っていたことを今でも覚えているでしょう。楽しい思い出ではないかもしれませんし、彼女が何を説明しようとしていたか覚えていないかもしれませんが、分子は私たちの存在全体を形成するので、分子と化合物を取り巻く専門用語を簡単に復習することはおそらく良いことです.

化学の授業 (写真提供:エレガントなソリューション/Shutterstock)
分子図を見たり、分子式を読んだりしても、分子を見ているのか化合物を見ているのかすぐにはわからないことがあります。実際、これら 2 つの指定に違いがあるかどうかさえわからないかもしれません。簡単に言えば、すべての化合物は分子ですが、すべての分子が化合物というわけではありません。これが頭の体操のように感じる場合は、読み続けて、もう少し詳細を確認してください。
分子と化合物
「分子」と「化合物」という言葉は、化学や材料科学に関する会話の中で、非常にさりげなく、しばしば同じ意味で使われます。これには十分な理由があります。正式な定義は非常に微妙であり、一部の重複があり、各分類の境界についての議論もあります.
分子
簡単に言えば、分子は化学的に結合した 2 つ以上の原子で構成される粒子です。これらの分子は特定の数の原子核を持ち、個々の粒子と見なすことができます。粒子が 1 種類の原子だけで構成されている場合でも、さまざまな異なる原子で構成されている場合でも、粒子は分子と見なされます。水素原子を 2 つしか含まない最も基本的な H2 分子から、数百万の塩基対と原子で構成される複雑な DNA 高分子に至るまで、小さな分子と大きな分子があり、「分子」は非常に多様な言葉に適用されます。

水素分子 (H2) (写真提供:LoopAll/Shutterstock)
ただし、純粋に NaCl で構成されている塩の粒を見た場合、それは分子とは見なされません。実際には、個々の塩化ナトリウム化合物粒子の巨大な格子ネットワークであり、明確な原子数がないためです。核。水滴を見ても同じことが言えます。あなたが見ているのは水の分子ではなく、肉眼で見ることができるほど高い濃度の液体 H2O 分子の巨大なグループです!

これまで、分子は共有結合によってのみ結合された粒子として定義されていました。これは、電子の共有によって生じる結合を意味します。 O3、たとえばオゾン分子の場合、その分子を構成する 3 つの酸素原子は独自の方法で結合しています。酸素原子のうちの 2 つが二重共有結合 (2 対の電子が共有されている) によって結合されており、それらの酸素原子の 1 つが同時に 3 番目の酸素原子と配位共有結合を共有しています。
このタイプの分類は、イオン結合を使用する他の粒子を明確に区別しましたが、共有結合とイオン結合の間の相互作用のレベルが完全には理解されていないことがすぐに判明したため、結合タイプに基づいて分子として分類することは賢明ではありませんでした。これは、今日一般的に受け入れられ、理解されている分子の非常に広い定義につながりました.2つ以上の原子は、一定数の原子核と化学結合によって結合されています.前述のように、すべての化合物は分子ですが、すべての分子が化合物であるとは限りません。
共有化合物
これは、分子が少なくとも 2 つの異なる要素で構成されている場合を具体的に示すために使用されるラベルです。たとえばメタンは、近年大きな注目を集めている温室効果ガスです。メタンは化学式 CH4 を持ち、1 つの炭素原子と 4 つの水素原子で構成され、すべて互いに共有結合しています。各水素原子は、炭素原子と 1 つの電子を共有します。メタン (CH4)、水 (H2O)、塩化炭素 (CCl4)、アンモニア (NH3)、およびその他の無数の共有結合化合物は、分子結合のみに依存して形成されるため、分子と化合物の両方と見なされます。
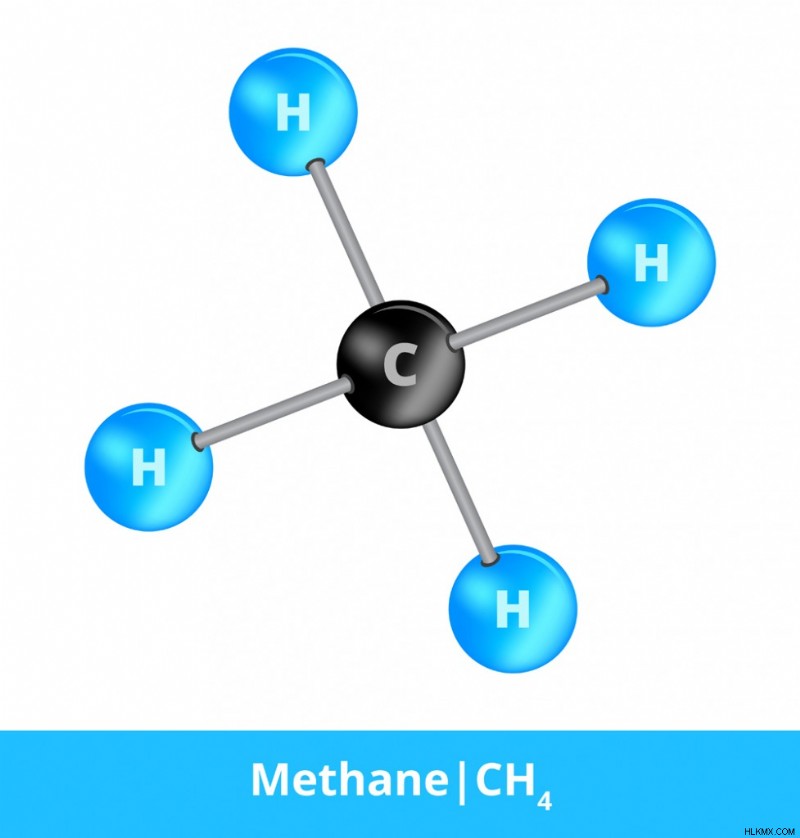
メタン (CH4) 共有結合 (写真提供:petrroudny43/Shutterstock)
イオン化合物
イオン化合物は共有結合に似ていますが、2 つの原子の電子がどのように相互作用するかという点で異なります。イオン化合物は、イオン結合を介して接続された複数の元素の原子のグループとして正式に定義されています。共有 (分子) 結合では電子が共有されますが、イオン結合では 1 つまたは複数の電子が別の原子に完全に与えられます。これは、反対に帯電したイオン間にイオン結合が形成されるためです。簡単に言えば、電子の過剰または不足により、イオンは正または負の電荷を持つ場合があります。これらの反対に帯電したイオンが結合すると、イオン結合が形成されます。通常、2 つのイオン間の強力な引力により、イオン結合は共有結合よりも強力です。

おそらく、イオン性化合物の最も一般的な例は、食卓塩の NaCl です。中性のナトリウム原子 (Na) は電荷を持っていませんが、その原子が電子を失うと、正味の電荷が +1 のナトリウム イオンになります。同様に、中性の塩素原子には電荷がありませんが、その原子が電子を獲得した場合、正味のイオン電荷は -1 になります。これらの 2 つのイオン (それぞれ陽イオンと陰イオン) が一緒になると、塩素から余分な電子がナトリウムに与えられます。これにより、2 つの原子が安定し、両方の原子の外側の電子殻が十分に満たされ、イオン化合物が形成され、共有結合よりも壊れにくい強力な結合が形成されます。
最後の言葉
言葉には大きな力があるため、科学の特定の分野について議論するときは、正しい言葉を使用することが重要です。分子と化合物に関しては、この 2 つには微妙な違いがありますが、ほとんどの目的と会話では、この 2 つを同じ意味で使用できます。ただし、H2 や O3 など、1 種類の元素だけで構成される分子について話している場合は、しないことを確認してください。 それを化合物と呼ぶために!次回、味気ない食事に塩をふりかけるときは、イオン結合のおかげで感謝の気持ちを伝えましょう!







