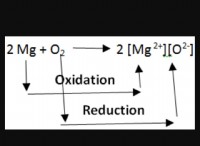
その理由は次のとおりです。
* 原子構造: 原子は、安定性のために電子の完全な外殻を持つように努力しています。
* 価電子: 価電子は、最も外側のシェルの電子です。
* オクテットルール: ほとんどの要素では、完全な外側シェルには8つの価電子が含まれています。この構成は、非常に反応性のない貴族の安定した電子構成に似ています。
オクテットルールの例外:
* 水素とヘリウム: 彼らは、最も外側のシェルを満たすために2つの電子を必要とするだけです。
* 3行目以降の要素: これらの要素は、D軌道が利用可能であるため、8つ以上の価電子を収容できる場合があります。
安定性が重要なのはなぜですか?
* 反応性: 完全な外側のシェルを持つ原子は一般的に反応しません。
* 結合: 完全な外側シェルを持たない原子は、安定性を達成するために他の原子と化学結合を形成する傾向があります。