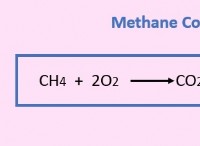
1。電子構成:
* プロトンは電子の数を決定します: 中性原子では、プロトンの数は電子の数に等しくなります。
* 電子は特定のエネルギーレベル(シェル)と軌道を占有します: 電子構成として知られるこれらのエネルギーレベルと軌道における電子の配置は、元素の化学的挙動を決定します。
* 電子構成の定期的な傾向: 周期表の周期(行)を移動すると、陽子の数が増加し、電子が同じ外側シェルに加えられます。これにより、原子の反応性に影響を与える価電子電子(最も外側のシェルの電子)の数が徐々に増加します。
* 原子サイズの定期的な傾向: グループ(列)の下で、電子シェルの数が増加し、原子が大きくなります。これは、最も外側の電子が核からさらに離れており、内側の電子によるシールドの増加により、核と価電子の間の静電引力が減少するためです。
2。化学的特性の定期的な傾向:
* イオン化エネルギー: 気体原子から電子を除去するために必要なエネルギー。 核と価電子の間により大きな引力を持つ原子では、より高いイオン化エネルギーが観察され、これは陽子の数の影響を受けます。
* 電子親和性: エネルギーの変化は、電子が気体原子に加えられたときの変化。電子の強い魅力を持つ元素では、より高い電子親和性が発生します。これは、核電荷(陽子の数)の影響を再び受けます。
* 電気陰性度: 原子が結合中に電子を引き付ける能力。 電気陰性度は一般に、核電荷の増加により期間にわたって増加し、原子サイズとシールドの増加によりグループを減少させます。
* 金属文字: 周期テーブルの左側の要素は、電子を失い、陽性イオンを形成する傾向があり、金属特性を示します。これは、陽子の数によって決定される原子価電子の数の影響を受けます。
3。周期表の理解:
周期表は、この周期性の視覚的表現です。要素は、原子番号に基づいて編成され、電子構成の繰り返しパターンにより、同様の化学的性質を共有します。
要約: 原子(原子番号)の陽子の数は、その電子構成に直接影響し、それが要素の化学的特性を支配します。周期表は、これらの繰り返しの傾向を反映しており、テーブル内の位置に基づいて要素の動作を予測および理解することができます。