その理由は次のとおりです。
* 強さ: 酸と塩基の強さは異なります。 強酸と塩基は溶液中に完全にイオン化します。つまり、それぞれすべての陽子(H+)または水酸化物イオン(OH-)を寄付または受け入れます。弱酸と塩基は部分的にのみイオン化します。 たとえば、塩酸(HCl)は強酸ですが、酢酸(CH3COOH)は弱酸です。
* 酸またはベースの性質: さまざまな種類の酸と塩基があります:
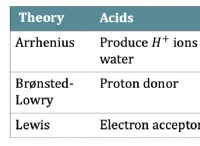
* arrhenius酸: これらは水中のH+イオンを放出します。
* arrheniusベース: これらは水中のオハイオンを放出します。
* brønsted-lowry酸: これらは陽子(H+)を寄付します。
* brønsted-lowryベース: これらは陽子(H+)を受け入れます。
* ルイス酸: これらは電子ペアを受け入れます。
* ルイスベース: これらは電子ペアを寄付します。
* 特定の反応: 酸塩基反応の特定の生成物は、個々の反応物に依存します。例えば:
* NaOHのような強いベースと反応するHClのような強酸は、塩(NaCl)と水(H2O)をもたらします。
* NaOHのような強い塩基と反応する酢酸(CH3COOH)のような弱酸は、塩(CH3COONA)と水(H2O)をもたらしますが、反応はそれほど完全ではありません。
要約:
すべての酸と塩基は、陽子移動または電子ペアの共有に関与する共通の特性を共有していますが、それらの特定の反応とイオン化の程度は、その強度と化学的性質に基づいて大きく異なります。