* 同様の反応性: ナトリウムとカリウムの両方は、周期表と同じグループ(アルカリ金属)にあります。これは、+1カチオンを形成するために1つの電子を失う強い傾向を含む、彼らが同様の化学的特性を持っていることを意味します。
* 反発: 同じ電荷の2つの原子(Na+または両方のK+の両方)が近くに近づくと、引き寄せではなく静電反発が発生します。これにより、それらが安定したイオン結合を形成することを防ぎます。
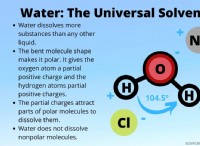
イオン結合 通常、有意に異なる電気陰性度の原子間で発生し、1つの原子は電子(金属)を容易に失い、もう1つの原子は電子(非金属)を容易に獲得します。これにより、お互いを引き付ける反対に帯電したイオンが作成されます。
例: ナトリウム(Na)と塩素(Cl)は反応して、一般的なテーブル塩である塩化ナトリウム(NaCl)を形成します。ナトリウムは電子を失い、Na+になりますが、塩素は電子を獲得してCl-になります。これらの反対に帯電したイオンは互いに引き付けられ、イオン結合を形成します。
ナトリウムとカリウムの場合、どちらも塩素や酸素などの非金属元素と相互作用して、安定したイオン化合物を形成することを好みます。