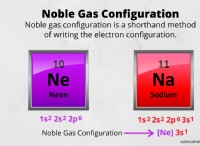
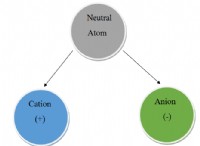
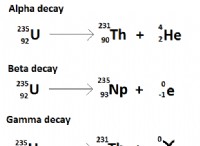
溶解度に影響する要因:
* 溶質と溶媒の性質:
* "like like dislols like": 同様の極性を持つ物質は、互いに溶解する傾向があります。
* 極性溶媒: 水(h₂o)、エタノール(c₂h₅oh)
* 非極性溶媒: オイル、脂肪、ヘキサン(c₆h₁₄)
* イオン化合物: 一般に、イオンと極性溶媒分子の間の静電引力のために、極性溶媒によく溶解します。
* 共有化合物: 極性または非極性である可能性があり、その溶解度は極性に依存します。
* 温度:
* 固体と液体: 通常、溶解度は温度の上昇とともに増加します。
* ガス: 温度が上昇すると溶解度が低下します。
* 圧力:
* ガス: 溶解度は、圧力の増加とともに増加します。
* 粒子サイズ:
*粒子サイズが小さくなると表面積が増加し、溶解が速くなります。
溶解プロセス:
1。溶媒との相互作用: 溶質粒子(イオンや分子など)は、溶媒分子と接触します。
2。引力の克服: 溶媒分子は、溶質粒子を一緒に保持する引力を克服する必要があります(たとえば、イオン結合、水素結合)。
3。溶媒和/水和: 溶媒分子は溶質粒子を囲み、溶媒和シェルを形成します。水の場合、これは水和と呼ばれます。
4。平衡: 飽和溶液では、溶解速度は結晶化速度に等しく、溶質の濃度は一定のままです。
溶解度の種類:
* 誤り: 互いに完全に溶解する液体(水とエタノールなど)。
* 不混意: 互いに溶解しない液体(油や水など)。
* 飽和: 特定の温度と圧力での溶質の最大量を含む溶液。
* 不飽和: 溶質の最大量未満を含むソリューション。
* 超飽和状態: 通常、特定の温度と圧力で保持できるよりも多くの溶質を含むソリューション。
溶解度の実用的な応用:
溶解度は、さまざまな分野で重要な役割を果たします。
* 化学: 化学反応、精製、および分析。
* 薬: 薬物送達、製剤、および生物学的利用能。
* 環境科学: 水質汚染、土壌汚染、修復。
* 食品科学: 食品加工、フレーバー、保存。
溶解度について具体的な質問がある場合、または関連する要因のいずれかの詳細な説明が必要な場合はお知らせください。