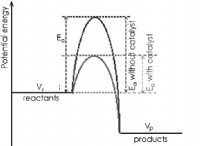
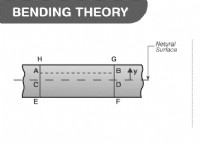
1。融点と原子半径:
* 一般的な傾向: 一般に、より大きな原子半径は低いにつながります 融点。
* 説明: より大きな原子は、より弱い金属結合(金属)またはより弱い分子間力(非金属)を持っています。これは、外側の電子が核からさらに遠く、静電魅力が弱くなるためです。
2。融点と電気陰性度:
* 一般的な傾向: より高い電気陰性度は一般により高いにつながります 融点(いくつかの例外を除き)。
* 説明: 電気陰性度は、電子を引き付ける原子の能力を反映しています。 より高い電気陰性度は、より強力な結合につながり、より多くのエネルギーを壊す必要があり、より高い融点をもたらします。
3。融点とイオン化エネルギー:
* 一般的な傾向: イオン化エネルギーが高いほど、一般により高いにつながります 融点。
* 説明: イオン化エネルギーは、電子を除去するのに必要なエネルギーです。 イオン化エネルギーが高いほど、核とその電子の間のより強い引力が示されます。これにより、結合が強くなり、壊れるためにより多くのエネルギーが必要であり、したがって融点が高くなります。
重要な考慮事項:
* 結合の種類: 上記の関係は一般的な傾向であり、存在する結合の種類(イオン、共有、金属)の種類によって影響を受ける可能性があります。 たとえば、イオン化合物は通常、静電力が強いため、共有化合物よりも高い融点を持っています。
* その他の要因: 結晶構造、圧力、不純物などの要因も融点に影響を与える可能性があります。
例:
アルカリ金属(Li、Na、K、RB、CS)を考えてみましょう。グループを下ると、原子半径が増加し、電気陰性度が低下し、イオン化エネルギーが減少します。 その結果、グループを下ると融点が減少します。
要約:
これらの特性は相互接続されていますが、融点と原子半径、電気陰性度、およびイオン化エネルギーの関係は必ずしも簡単ではありません。関与する結合の性質やその他の影響要因を理解することは、融点について正確な予測を行うために重要です。