酸:
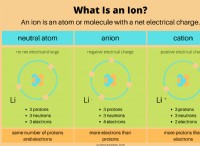
* 解離: 酸が水に溶解すると、水素イオン(H+)とアニオン性成分を放出します。たとえば、塩酸(HCl)はH+およびCl-イオンに解離します。
* 導電率: 溶液中のこれらの遊離イオン(H+およびCL-)は電荷を運ぶことができ、溶液を導電性にします。
ベース:
* 解離: 水酸化ナトリウム(NAOH)のような塩基も水に分離します。それらは、水酸化物イオン(OH-)およびカチオン性成分を放出します。 NaOHの場合、それはNa+およびoh-イオンを形成します。
* 導電率: 遊離水酸化物イオン(OH-)の存在と溶液中の陽イオン成分は、電流の流れを可能にします。
要約:
酸と塩基が溶液中に解離し、イオンを形成する能力が、電解質を作る重要な要因です。 溶液中のこれらのイオンの存在は、電気の伝導を可能にします。
重要な注意: 酸と塩基が解離する程度(したがって導電率)は、その強度に依存します。強酸と塩基は完全に解離しますが、弱酸と塩基は部分的にしか解離しません。