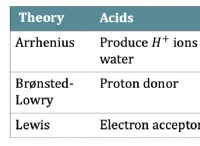
1。強い静電力:
*イオン化合物は、金属原子(電子を失う傾向がある)が非金属原子(電子を獲得する傾向がある)と反応するときに形成されます。
*この電子の伝達は、正に帯電したイオン(陽イオン)と負に帯電したイオン(アニオン)を生成します。
*これらのイオンは、強い静電アトラクションによって結合され、硬い格子構造を形成します。
2。格子エネルギー:
*静電力の強度は、格子エネルギーによって定量化されます。これは、1モルのイオン固体をその気体イオンに分解するために必要なエネルギーです。
*格子エネルギーが高いほど、イオン結合が強くなり、それらを壊すことがより困難になります。
3。融解と沸騰:
*イオン固体を溶かすには、静電力を克服し、イオンが互いに移動するのに十分なエネルギーを提供する必要があります。
*イオン固体を沸騰させるには、イオンを完全に分離するためにさらに多くのエネルギーが必要で、気体状態になります。
融点と沸点に影響する要因:
* チャージ: イオンのより高い電荷は、より強いアトラクションとより高い融点/沸点につながります。
* サイズ: 電荷密度が大きい小さなイオンは、静電力が強くなり、融点/沸点が高くなります。
* 構造: 格子内のイオンの配置は、相互作用の強さにも影響します。
要約:
イオン格子内でイオンを一緒に保持する強力な静電力は、克服するためにかなりのエネルギーを必要とします。これにより、分子間の力が弱い共有化合物と比較して、イオン化合物の溶融点と沸点が高くなります。