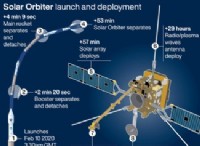
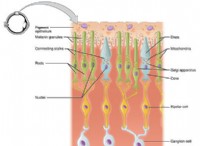
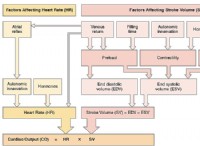
一般式:
酸 +ベース→塩 +水
例:
塩酸(HCl) +水酸化ナトリウム(NAOH)→塩化ナトリウム(NaCl) +水(H₂O)
視覚表現:
塩酸(HCl)のような強酸の溶液を備えたビーカーを持っていると想像してください。それは酸性で、pHが低い(0-2前後)。ここで、水酸化ナトリウム(NAOH)のような強力な基部の溶液を追加します。ベースには高いpH(約12〜14)があります。
ベースを追加すると、ソリューションは酸性度が低くなり始めます。 pHは徐々に増加し、より中性(7に近い)になります。 これは、溶液のpHに応じて色を変えるpHインジケーターを使用して視覚的に観察できます。
キーポイント:
* 酸 溶液中の水素イオン(H+)を放出する物質です。
* ベース 溶液中に水酸化物イオン(OH-)を放出する物質です。
* 塩 酸と塩基の反応によって形成されるイオン化合物です。
* 水 pHが7の中性化合物です。
日常生活における中和反応:
中和反応はどこにでもあります:
* 制酸剤: これらの錠剤には、過剰な胃酸を中和する塩基が含まれています。
* 石鹸: 石鹸は、脂肪を塩基と反応させることによって作られ、脂肪を中和し、石鹸のテクスチャーを作成します。
* 農業: 農家は石灰(酸化カルシウム)を使用して酸性土壌を中和し、植物の成長に適しています。
重要な注意:
酸とベースの強度は、他方を完全に中和するためにそれぞれのどれだけが必要かを決定します。強酸と強い塩基は完全に反応しますが、弱酸と弱い塩基は互いに部分的にしか中和しないかもしれません。