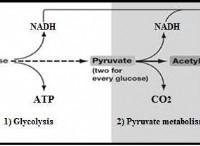
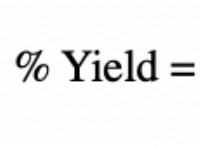量子数と軌道の構造
* 主要な量子数(n): この数値は、電子のエネルギーレベルについて説明しています。 たとえば、n =1、2、3などは、それぞれ1番目、2番目、3番目のエネルギーレベルを表します。
* 角運動量量子数(l): この数字は、軌道の形状を説明しています。 s軌道の場合、l =0。
* 磁気量子数(ml): この数字は、空間内の軌道の方向について説明しています。 s軌道の場合、l =0、ml =0であるため。これは、s軌道に可能な方向が1つしかないことを意味します。
* スピン量子数(MS): この数値は、電子の固有の角運動量について説明します。これも量子化されています。電子の2つのスピン状態を表す+1/2または-1/2のいずれかである可能性があります。
パウリ除外原理
* パウリ除外原理は、原子内の2つの電子が4つの量子数すべてのセットを持つことができないと述べています。 これは、特定の軌道(nとlで定義)内で、2つの電子のみが存在できることを意味し、反対のスピンが必要です。
要約
* S軌道には球形があり、そのための可能な方向は1つしかありません。
*パウリの除外原理は、軌道の電子の数を2つに制限し、それぞれ反対のスピンを備えています。
視覚化:
S軌道を球体と考えてください。 この球体に1つの電子を配置でき、+1/2のスピンがあります。 同じ球体に2番目の電子を配置できますが、パウリ除外原理を満たすために-1/2のスピンが必要です。