コア コンセプト
このチュートリアルでは、利回りの割合について学びます とその計算方法です。さらに、計算例について説明します。
他の記事で取り上げるトピック
- モル質量の計算
- 周期表の読み方
- 分子式と経験式
- 化学反応を簡単に
利回り率とは?
実験を行うとき、完全な反応条件があれば最大の収量が得られます。これは理論収量です .ただし、実験を正しく行ったとしても、製品の完全な収量が得られない可能性があります。最終的に得られる製品の量が実際の収量です .
実験で得られた理論上の収量のパーセンテージがパーセント収量です .以下で計算方法を学びましょう!
利回りの計算方法
以下の式を使用して、実験からの収益率を計算できます:
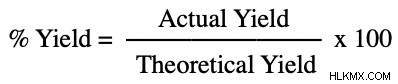
理論収量の計算
まず、実験の理論収量を計算する必要があります。通常、これには化学量論的計算が含まれます。最初に与えられた化学式と情報を見ることで、何が反応し、どのように生成物が形成されているかを理解することができます.
制限試薬がなくなるとそれ以上の生成物は形成されないため、次のステップは制限試薬を特定することです。
次に、次元分析を使用して、与えられた制限試薬の量に基づいて形成できる生成物の量を確認できます。これは実験の理論上の収量です。
実際の収量の計算
物理的に実験を行っている場合、実際の収量は天秤で量った製品の量になります。単語問題をしている場合、実際の収量は問題内に示されている場合があります。
利回りの式
理論上の収量と実際の収量の両方が得られたら、最後のステップは数値を式に代入することです。実際を理論値で割ると、作成した製品の割合が得られます。これに 100 を掛けると、収率が得られます。
利回りの計算例
歩留まりを計算する手順がわかったので、例を見てみましょう:
以下のバランスの取れた化学反応を使用してください。 40.00 g のアセチレン (C2 H2 ) と 65.00 g の酸素が使用され、25.00 g の水が生成されます。収率は何パーセントですか?
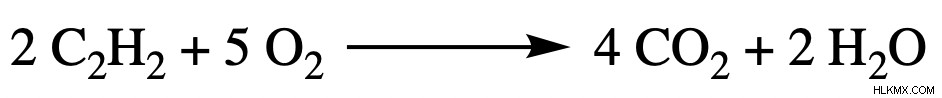
最初のステップは、限界試薬と水の理論収量を見つけることです:

両方の試薬の寸法分析を使用すると、アセチレンは酸素よりも少量の生成物を生成することがわかりました。このため、アセチレンは私たちの制限試薬です.
27.67g は理論収量です。最後のステップは、数値を歩留まりの式に当てはめることです。
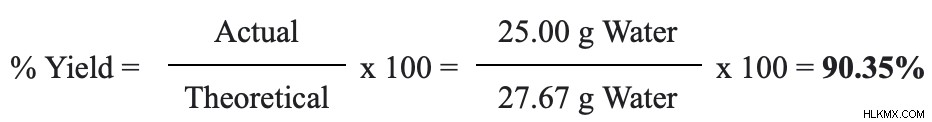
当社の歩留まりは 90.35% です。
その他の質問例については、ここをクリックしてください。
さらに読む
- 一般的な多原子イオン
- 運動分子理論
- E1 反応
- E2 反応







