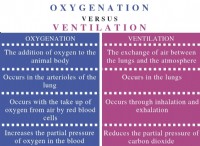
1。可能な製品を特定します:
* バランスの取れた化学式を書きます: これは、反応物と潜在的な製品を示しています。
* 反応の種類を考慮してください: 沈殿物の形成につながる一般的な反応は次のとおりです。
* 二重変位反応: 2つのイオン化合物が反応し、イオンを交換します。
* 中和反応: 酸と塩基が反応して塩と水を形成します。
2。溶解度ルールを適用してください:
* 溶解度ルール: これらは、水中のイオン化合物の溶解度を予測するガイドラインです。それらは、陽イオンと陰イオンのアイデンティティに基づいています。
* 一般規則:
* ほとんどのアルカリ金属(グループ1)塩は可溶性です。
* ほとんどのアンモニウム(nh₄⁺)塩は可溶性です。
* ほとんどの硝酸塩(no₃⁻)塩は可溶性です。
* ほとんどの塩化物(cl⁻)、臭化物(br⁻)、ヨウ化物(i⁻)塩は可溶性です。
* ほとんどの硫酸塩(so₄²⁻)塩は、バリウム(ba²⁺)、ストロンチウム(sr²⁺)、カルシウム(ca²⁺)、鉛(pb²⁺)、銀(ag⁺)のものを除き、溶けやすい。
* ほとんどの炭酸塩(co₃²⁻)、リン酸(po₄³⁻)、硫化物(s²⁻)、および水酸化物(oh⁻)塩は、アルカリ金属とアンモニウムのものを除き、不溶性です。
3。製品の溶解度を分析します:
* 溶解性ルールに従って製品が不溶性の場合、解決策から沈殿します。
* 両方の製品が可溶性の場合、沈殿物は形成されません。
4。反応化学量論を考慮してください:
* 制限反応物を決定します: 完全に消費される反応物は、最初に最初に形成できる製品の量を制限します。
* 形成された沈殿物のモルを計算します: バランスの取れた方程式の化学量論係数を使用します。
5。 降水に影響する要因:
* 反応物の濃度: 濃度が高いほど降水の可能性が増加します。
* 温度: 溶解度は温度とともに増加することが多いため、溶液を冷却すると降水が促進されます。
* 一般的なイオン効果: 別のソースからの一般的なイオンの存在は、控えめに溶けやすい塩の溶解度を低下させる可能性があります。
例:
鉛(II)硝酸鉛(PB(no₃)₂)とヨウ化カリウム(KI)の間の反応を考えてみましょう。
pb(no₃)₂(aq) + 2ki(aq)→pbi₂(s) +2kno₃(aq)
* 溶解度ルール: 鉛(II)ヨウ化物(PBI₂)は不溶性ですが、硝酸カリウム(Kno₃)は可溶性です。
* 降水量: 鉛(II)ヨウ化物は黄色の固体として沈殿します。
注:
*一部の化合物はわずかな溶解度を持っている可能性があるため、溶解性ルールが可溶性であると予測する場合でも、少量の沈殿物が依然として形成される可能性があります。
*沈殿物の形成の予測は、特に複雑な反応では困難な場合があります。多くの場合、参照資料を相談し、実験を実施して結果を確認することは役立つことがよくあります。