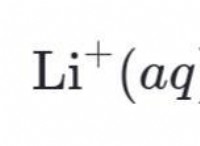凍結点うつ病:
* 何が起こるか: 溶液の凍結点は、純粋な溶媒と比較して減少します。
* 理由: 溶質粒子は、溶媒の結晶格子の形成を破壊し、溶媒が固化するのが難しくなります。
* 例: 塩を水に追加すると、凍結点が低下するため、塩を使用して道路で氷を溶かすために使用されます。
沸点の標高:
* 何が起こるか: 溶液の沸点は、純粋な溶媒と比較して増加します。
* 理由: 溶質粒子は、溶媒の蒸気圧を下げます。これは、蒸気圧力の低下と沸騰を克服するために、ソリューションがより高い温度に達する必要があることを意味します。
* 例: 砂糖を水に追加すると、沸点が上昇するため、水よりも高い温度で砂糖のようなシロップが沸騰します。
覚えておくべきキーポイント:
* 溶質の性質: 凍結点のうつ病と沸点の上昇の大きさは、溶質の性質に依存します。たとえば、イオン溶質は一般に、非イオン性溶質よりも大きな効果があります。
* 溶質の濃度: 溶質を追加するほど、凍結ポイントと沸点の変化が大きくなります。
* 衝突特性: 凍結点のうつ病と沸点の上昇は、衝突特性の例です。これらは、溶質のアイデンティティではなく、溶液中の溶質粒子の数のみにのみ依存する特性です。
式:
* 凍結点うつ病: Δt f =k f * m
* 沸点の標高: Δt b =k b * m
どこ:
*Δt f =凍結点の変更
*Δt b =沸点の変更
* k f =凍結点うつ病定数(溶媒に固有)
* k b =沸点標高定数(溶媒に固有)
* M =溶液のモルリアル(溶媒のキログラムあたりの溶質のモル)
これらの式を使用して、特定のソリューションの凍結ポイントと沸点の予想される変化を計算できます。