* グループ1および2(アルカリとアルカリの土の金属):
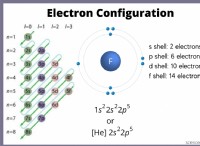
* 高い反応性: これらの要素には、1つまたは2つの価電子(最も外側のシェルの電子)のみがあります。彼らはこれらの電子を容易に失い、安定した電子構成を実現し、正のイオンを形成します。
* 電気陽性の性質: これにより、それらは非常に反応性が高く、非金属とのイオン結合を容易に形成します。 これは、膨大な一連の化合物の形成につながります。
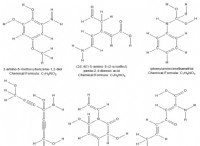
* 例: 塩化ナトリウム(NaCl)、炭酸カルシウム(CACO3)、水酸化カリウム(KOH)など。
* グループ18(Nobleガス):
* 安定した電子構成: 貴重なガスには電子の完全な外側の殻があり、非常に安定して不活性になります。
* 結合する傾向の欠如: 彼らは容易に電子を獲得したり失ったりしません。
* 限定化合物: それらは非常に少数の化合物を形成し、主にフッ素のような非常に感動的な元素を備えています。
* 例: キセノンテトラフルオリド(XEF4)、フッ化アルゴン(ARF)など(これらは比較的まれであるため、これらは例外です)。
要約: 電子の構成によって駆動される反応性の違いは、グループ1と2の要素が多くの化合物を形成する理由を説明しますが、グループ18要素はほとんど非影響を受けず、少数の化合物を形成します。