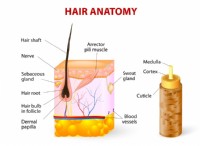
* 係数: これらは、反応の各化学式の前に配置された数字です。それらは、反応に関与する各反応物と生成物のモル数を表します。 係数は、方程式の反応物側(左側)の各要素の原子数が、製品側のその要素の原子数(右側)に等しいことを保証するために使用されます。
例:
不均衡: h₂ +o₂→h₂o
バランス: 2h₂ +o₂→2h₂o
この例では、係数「2」は反応物側のh₂の前に配置され、製品側のh₂oは、方程式の両側の水素と酸素原子の数のバランスをとります。
バランスが重要な理由:
* 質量の保存: 化学方程式のバランスは不可欠です。これは、質量の保存法則を反映しているためです。この法律は、閉じたシステムでは、化学反応前の反応物の総質量は、反応後の産物の総質量に等しくなければならないと述べています。
* 正確な化学量論: バランスの取れた方程式は、化学反応における反応物と生成物の定量的関係を理解するために重要な正確な化学量論比を提供します。これにより、収量、試薬の制限、およびその他の重要な要因の正確な計算が可能になります。
* 反応結果の予測: バランスの取れた方程式は、化学反応の生成物とその相対量を予測するのに役立ちます。
化学方程式のバランスをとることは化学の基本的な概念であり、化学反応を理解して予測するために不可欠であることを忘れないでください。