リチウム(li)は電子を失います:
*リチウムには1つの原子価電子(最も外側のシェル)があります。
*この電子を失うことにより、リチウムは、Noble Gas Heliumに似た安定した電子構成を実現します。
*積極的に帯電したイオン(Li+)になります。
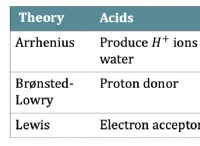
塩素(Cl)は電子を獲得します:
*塩素には7つの原子価電子があります。
* 1つの電子を獲得することにより、塩素は、Noble Gas Argonに似た安定した電子構成も実現します。
*それは負に帯電したイオン(CL-)になります。
イオン結合形成:
* li+とcl-の反対の料金は、互いを強く引き付けます。
*イオン間のこの静電引力は、イオン結合を形成します。
*複数のLi+とcl-イオンが一緒になって、塩化リチウム(LICL)として知られる結晶格子構造を形成します。
塩化リチウムの特性:
* liClは白い結晶固体です。
*イオンと水分子の間の強い魅力のため、水に非常に溶けます。
*強いイオン結合により、融点が高くなります。
本質的に、リチウムが電子を失い、塩素を獲得するプロセスは、ユニークな特性を持つ安定したイオン化合物を作成します。