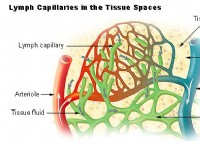
その理由は次のとおりです。
* 有機化合物は通常共有結合です: イオン(荷電粒子)を形成するのではなく、電子を共有します。これは、水に溶解したときにイオンに容易に解離しないことを意味します。
* 導電率にはイオンが必要です: 電気を導入するためのソリューションには、自由移動帯電粒子(イオン)が必要です。
* 例外: いくつかの例外があります:
* イオン有機化合物: カルボン酸の塩(酢酸ナトリウム)の塩などのいくつかの有機化合物はイオン性であり、溶液中の電気を導きます。
* 強酸と塩基: 強力な有機酸(トリフルオロ酢酸など)と塩基(例えば、水酸化ナトリウム)は、水中で広範囲にイオン化し、導電率につながる可能性があります。
* 極分子: 完全にはイオンではありませんが、一部の極性有機分子(糖、アルコールなど)は、水中でわずかなイオン化を行うことができ、導電率が非常に弱くなります。
一般に、水中の有機化合物の大部分は、電流を運ぶために必要な遊離イオンが不足しているため、電気を導入しません。